
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
 .
. 分析 由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Na、f为Cl.
(1)最简单的有机物为甲烷;
(2)e为Na元素;
(3)同周期自左而右元素非金属性增强;
(4)a元素和f元素形成化合物为HCl,属于共价化合物,H原子与Cl原子之间形成1对共用电子对.
解答 解:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Na、f为Cl.
(1)最简单的有机物为甲烷,由碳元素与氢元素组成,故答案为:a;
(2)e为Na元素,故答案为:Na;
(3)同周期自左而右元素非金属性增强,故答案为:增强;
(4)a元素和f元素形成化合物为HCl,属于共价化合物,H原子与Cl原子之间形成1对共用电子对,电子式为: ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表与元素周期律,比较基础,注意熟练掌握元素周期表,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原混合气体的体积为1.2V L | B. | 原混合气体的体积为1.1V L | ||
| C. | 反应达平衡时气体A消耗掉0.05V L | D. | 反应达平衡时气体B消耗掉0.05V L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
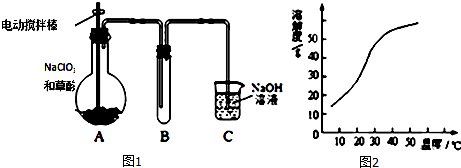
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B(OH)4-+H+;
B(OH)4-+H+;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
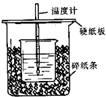 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 野火烧不尽,春风吹又生 | B. | 春蚕到死丝方尽,蜡炬成灰泪始干 | ||
| C. | 爆竹声中一岁除,春风送暖入屠苏 | D. | 粉身碎骨浑不怕,要留清自在人间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+C12$\stackrel{光}{→}$CH3Cl+HCl | B. | CH2=CH2+C12→ | ||
| C. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | D. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com