
【题目】关于有机物![]()
![]() 的说法正确的是
的说法正确的是
A. a、b互为同系物
B. c中所有碳原子可能处于同一平面
C. a、b、c均能使酸性高锰酸钾溶液褪色
D. b的同分异构体中含有羧基的结构还有7种(不含立体异构)
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH = — 92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是( )
2NH3(g) ΔH = — 92.0kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图所示,下列说法正确的是( )

A. 25min时采取的措施是降低温度或增大压强
B. 将0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量为46 kJ
C. Ⅰ、Ⅱ、Ⅲ 三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数:KⅢ > KⅠ = KⅡ
D. 为了增大合成氨的产率可以通过使用催化剂、原料的循环使用来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是

A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,铁可以和![]() 发生反应:
发生反应:![]() ,已知该反应的平衡常数
,已知该反应的平衡常数![]() 与温度
与温度![]() 的关系如图所示。
的关系如图所示。
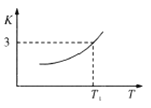
①该反应是_______________(填“吸热”或“放热”)的反应。
②在恒温恒容的容器中进行该反应,下列能说明反应达到平衡状态的是_____________(填字母代号)
A. ![]() 的浓度保持不变
的浓度保持不变
B.容器内总压强不再变化
C. ![]()
D.混合气体的平均相对分子质量不再变化
③![]() 温度下,向体积为
温度下,向体积为![]() 的密闭容器中加入足量铁粉并充入一定量的
的密闭容器中加入足量铁粉并充入一定量的![]() ,则
,则![]() 的平衡转化率为_______。
的平衡转化率为_______。
(2)甲醇燃料电池中,若电解质溶液中![]() 的物质的量为
的物质的量为![]() ,当有
,当有![]() 甲醇参与反应时,所得溶液中离子浓度由大到小的顺序是_________________________。
甲醇参与反应时,所得溶液中离子浓度由大到小的顺序是_________________________。
(3)用![]() 与
与![]() 干法制备
干法制备![]() 的反应历程中包含的热化学方程式有:
的反应历程中包含的热化学方程式有:
![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ______
______![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。![]() 早在1841年利用纯铁作电极插入浓的
早在1841年利用纯铁作电极插入浓的![]() 溶液电解制得
溶液电解制得![]() ,阳极生成
,阳极生成![]() 的电极反应式为___________;
的电极反应式为___________;![]() 等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是________。
等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取氢氧化钠的工艺流程示意图如下:
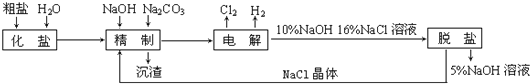
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_______________________,与电源负极相连的电极附近,溶液pH值_____________(选填:不变、升高或下降)
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为_______________________,_______________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是___________(选填a、b、c,多选扣分)
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为____________(选填a,b,c多选扣分)
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、___________(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和![]() ,相应的化学方程式为______________________。
,相应的化学方程式为______________________。
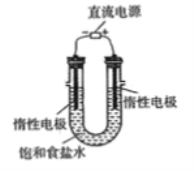
(7)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____________(填“>”、“=”或“<”)2L,原因是_____________________。
(8)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4→ZnSO4+H2↑、MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
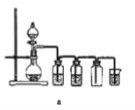
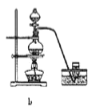
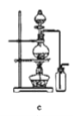
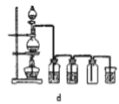
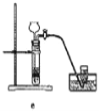
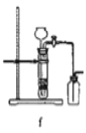
据此,制备并收集干燥、纯净Cl2的装置是______(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是
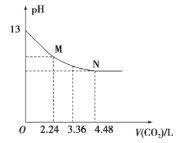
A. NaOH溶液的物质的量浓度为0.1 mol/L,体积为1 L
B. M、N点离子浓度的都是c(HCO3-)>c(CO32 -)
C. 曲线上任意点都符合:c(Na+)+c(H+)=c(CO32 -)+c(HCO3-)+c(OH-)
D. V=3.36 L时,溶液中的离子浓度关系是:c(Na+)>c(HCO3- )>c(CO32 -)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 ![]() 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
II:等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
III:已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11,含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________,常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]()
![]() xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
A. P的平均反应速率是0.15mol/(Lmin)
B. Q的转化率是25%
C. Q的平衡浓度是1mol/L
D. x的值为2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com