
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为_____(填字母)nm。
A.435 B500 C.580 D.605 E. 700
(2)元素S和Ca中,第一电离能较大的是_____(填元素符号),其基态原子核外电子排布式为_______。
(3)X射线衍射测定等发现,石膏(CaSO4 2H2O)中存在SO42-离子。SO42-离子的几何构型为_____,中心原子的杂化形式为________。
(4) 基态Ca原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为_____。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金展锰低,原因是_________________。
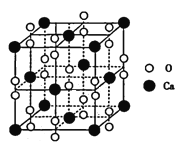
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g cm-3,则晶胞结构中最近的两个Ca2+间的距离为______ (列算式即可,用NA表示阿伏加德罗常数的数值)nm,与Ca2+紧邻O22-的个数为______。
【答案】 E S 2s22s22p43s23p4或{ [Ne] 3s23p4} 正四面体 sp3 N 球形 Ca原子半径较大且价电子数较少,金属键较弱 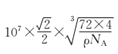 6
6
【解析】(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为700nm,故选E;
(2) 同周期从左至右,第一电离能逐渐增大;同族元素:从上至下第一电离能逐渐减小。元素S和Ca中,第一电离能较大的是S,S原子的基态原子核外电子排布式为2s22s22p43s23p4,故答案为:S;2s22s22p43s23p4;
(3) SO42-中S原子价层电子对=4+![]() (6+2-4×2)=4,且不含孤电子对,采用sp3杂化,所以是正四面体形结构,故答案为:正四面体;sp3;
(6+2-4×2)=4,且不含孤电子对,采用sp3杂化,所以是正四面体形结构,故答案为:正四面体;sp3;
(4) 基态Ca原子中,核外电子占据最高能层是第4层,能层符号是N,占据该能层的电子为4s电子,电子云轮廓图形状为球形。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,Ca原子半径较大且价电子数较少,金属键较弱,导致金属钙的熔点、沸点等都比金属锰低,故答案为:N;球形;Ca原子半径较大且价电子数较少,金属键较弱;
(5)根据过氧化钙晶体的晶胞结构,晶胞中含有Ca2+的数目为8×![]() +6×
+6×![]() =4,含有O22-的数目为12×
=4,含有O22-的数目为12×![]() +1=4,设晶胞的边长为x,则晶胞的密度是ρ g cm-3=
+1=4,设晶胞的边长为x,则晶胞的密度是ρ g cm-3=![]() ,解得x=
,解得x=![]() cm=
cm=![]() ×107 nm,因此晶胞结构中最近的两个Ca2+间的距离为面对角线的一半=
×107 nm,因此晶胞结构中最近的两个Ca2+间的距离为面对角线的一半=![]() ×
×![]() ×107 nm,与Ca2+紧邻O22-的个数为6个,故答案为:
×107 nm,与Ca2+紧邻O22-的个数为6个,故答案为:![]() ×
×![]() ×107 ;6。
×107 ;6。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.化学变化过程是原子的重新组合过程
B.生成物总能量高于反应物总能量的反应是吸热反应
C.需要加热才能发生的反应一定是吸热反应
D.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ/mol
CO(g)+H2(g) ΔH=+131.3 kJ/mol
H(g)+ H(g)![]() H2(g) ΔH=435.7 kJ/mol
H2(g) ΔH=435.7 kJ/mol
下列说法正确的是
A.氢原子的能量比氢分子的能量低
B.2个氢原子结合生成1个氢分子,放出435.7 kJ的能量
C.1 mol固态碳与1 mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJ
D.固态碳与液态水反应生成一氧化碳气体和氢气吸收131.3 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是:( )
A. c(NH4+)=c(SO42-) B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-) D. c(OH-)+c(SO42-) = c(NH4+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶和托盘天平
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA.下列说法正确的是( )
A. 1L0.1molL﹣1NH4Cl溶液中,NH4+的数量为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.反应NH3(g)+HCl(g)![]() NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
B.CaCO3(s)![]() CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
C.一定温度下,反应MgCl2(l)![]() Mg(l)+Cl2(g)的ΔH>0、ΔS>0
Mg(l)+Cl2(g)的ΔH>0、ΔS>0
D.常温下,反应C(s)+CO2(g)![]() 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的工业原料,课外小组以SO2为原料制取Na2S2O3的实验步骤如下:
I. 配制混合溶液
将Na2S和Na2CO3按2:1的物质的量之比混合,加入一定量的水,形成溶液。
II.预热、充分反应
将该溶液注入敞口反应釜中,加热反应釜一段时间,向反应釜中缓慢通入SO2至稍过量。
III.蒸发浓缩、冷却结晶
反应结束后加热浓缩溶液,冷却至30℃以下,析出大量Na2S2O3 5H2O。
IV.过滤、循环反应
滤出Na2S2O3 5H2O,烘干脱去结晶水,母液循环利用。
回答下列问题:
(1)步骤II预热时温度不宜过高,应将温度控制在50℃左右,其主要目的是____________。
(2)步骤II充分反应时的化学方程式为_______________________。
(3)步骤IV中的母液循环利用,其目的是在节约成本、减少污染的同时,提高________。
(4)为测定所得Na2S2O3产品的纯度,称取w g烘干后的Na2S2O3产品,先用适量蒸馏水溶解,再用a mol L-1碘的标准溶液滴定(2S2O32-+I2=2I-+S4O62-,且不考虑杂质与碘反应),以淀粉溶液作指示剂,滴定至终点时的现象为_________________。
若消耗碘的标准溶液的体积为b mL,则所得产品的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com