
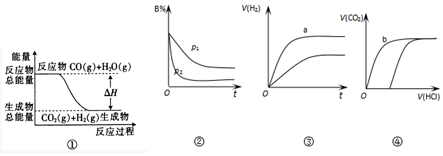
| A. | ①表示反应CO(g)+H2O(g)?CO2(g)+H2(g)中的△H大于0 | |
| B. | ②表示其它条件不变时,反应 4A(g)+3B(g)?2C(g)+6D(?)在不同压强下B% 随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | ④表示10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L HCl,产生CO2的体积随盐酸体积的变化,则b表示NaHCO3溶液 |
分析 A.反应物总能量大于生成物总能量,应为放热反应;
B.由图象可知P2>P1,增大压强B%降低,平衡向正反应方向移动.
C.醋酸为弱电解质,生成氢气较多;
D.碳酸氢钠反应较快,最终生成二氧化碳的物质的量相同.
解答 解:A.反应物总能量大于生成物总能量,应为放热反应,应为反应的△H小于0,故A错误;
B.由图象可知P2>P1,增大压强B%降低,平衡向正反应方向移动,则D一定不是气体,否则向逆反应方向移动,故B错误;
C.醋酸为弱电解质,生成氢气较多,表示的是醋酸溶液,故C正确;
D.碳酸氢钠反应较快,最终生成二氧化碳的物质的量相同,故D正确.
故选CD.
点评 本题考查较为综合,涉及反应热与焓变、化学平衡的建立、弱电解质的电离以及钠的重要化合物,侧重于考查学生化学知识的综合运用能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 所用的氢氧化钠固体放置于空气中过久 | |
| B. | 定容时,眼睛俯视刻度线 | |
| C. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| D. | 定容后摇匀,发现液面低于刻度线,不作处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液中OH-的物质的量浓度 | B. | 溶液的导电能力 | ||
| C. | 溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | D. | CH3COOH的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
| C | 碱石灰 | 盐酸 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、MnO4-、SO42-、CO32- | |
| B. | 在含大量 Ba2+的溶液中:NH4+、Na+、Cl-、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在 pH=1 的溶液中:K+、Fe2+、Cl-、CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com