
分析 (1)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的方程式;
(2)碱性溶液用碱式滴定管盛放;
(3)用NaOH标准溶液滴定硫酸,则溶液由酸性变碱性;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,据此计算;
(5)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(6)根据n(H2SO4)=2n(NaOH)=2V(碱)×c(碱),分析不当操作对n(酸)的影响,以此判断SO2含量的变化.
解答 解:(1)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,故答案为:SO2+H2O2=H2SO4;
(2)碱性溶液用碱式滴定管盛放,则NaOH标准溶液用碱式滴定管盛放,故答案为:碱式;
(3)用NaOH标准溶液滴定硫酸,则溶液由酸性变碱性,以酚酞为指示剂,所以滴定到终点溶液由无色变为浅红色,故答案为:无;浅红;
(4)若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以④正确,
故答案为:④;
(5)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×0.0900mol/L×0.025L×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:$\frac{0.072g}{0.3L}$=0.24g/L,
故答案为:0.24;
(6)A.滴定前,未用NaOH标准溶液润洗滴定管,则氢氧化钠的浓度减小,滴定时消耗的氢氧化钠偏多,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏大,则二氧化硫的物质的量偏大,即所测得的SO2含量偏高,故A正确;
B.滴定前滴定管内无气泡,终点读数时有气泡,则滴定时消耗的氢氧化钠偏少,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏小,则二氧化硫的物质的量偏小,即所测得的SO2含量偏低,故B错误;
C.滴定前仰视读数,滴定终点时读数正确,则滴定时消耗的氢氧化钠偏少,则n(H2SO4)=2n(NaOH)=2V(碱)×c(碱)可知计算得到的硫酸的物质的量偏小,则二氧化硫的物质的量偏小,即所测得的SO2含量偏低,故C错误;
故答案为:A.
点评 本题为考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
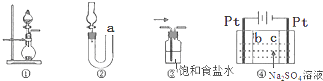
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里生成 n mol A2,同时消耗 2n mol AB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:1:2 | |
| D. | 单位时间里生成2n mol AB的同时生成n mol B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
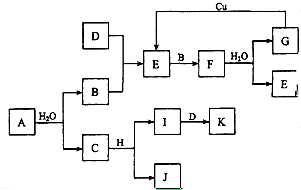 A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:
A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1所示反应:X(g)+2Y(g)?3Z(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图3表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
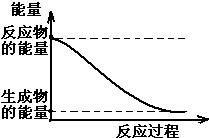 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可表示为
可表示为 ,则金刚乙烷、金刚乙胺的结构简式可用如图
,则金刚乙烷、金刚乙胺的结构简式可用如图 表示.
表示.
 +2NH3→
+2NH3→ +NH4Cl
+NH4Cl ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3)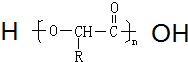 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
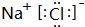 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com