
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易粉碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产Ni2O3的工艺流程如下:
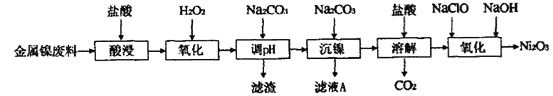
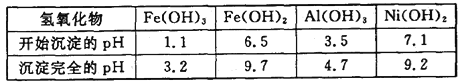
下表为金属离子生成氢氧化物沉淀的pH(设开始沉淀时金属离子浓度为1.0 mol·L-1):
回答下列问题:
(1)为提高金属镍废料浸出的速率,在“酸浸”时可采取的措施是___________。(写两点即可)
(2)酸浸后的酸性溶液中含有Ni2+、Fe2+、Fe3+、Al3+等。加H2O2的作用是__________,其离子方程式为______________________。
(3)在沉镍前,需加Na2CO3控制溶液pH的范围为__________。
(4)沉镍的离子方程式为_____________________。
(5)氧化生成Ni2O3的离子方程式为___________________。
【答案】升高温度;增加盐酸的浓度;粉碎;搅拌 把Fe2+氧化为Fe3+ 2Fe2++2H++H2O2=2Fe3++2H2O 4.7≤pH<7.1 Ni2++CO32-=NiCO3↓ 2Ni2++ClO-+4OH-=Ni2O3+Cl-+2H2O
【解析】
以金属镍废料生产Ni2O3,由流程可知,酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化Fe2+为Fe3+,加入碳酸钠溶液调节溶液的pH,使Fe3+、Al3+全部形成Al(OH)3、Fe(OH)3沉淀,过滤后向滤液中再加入碳酸钠沉淀镍离子得NiCO3沉淀,滤液A中含有NaCl等物质,将NiCO3经洗涤后再溶于盐酸得氯化镍溶液和二氧化碳,向溶液加入次氯酸钠和氢氧化钠溶液反应生成Ni2O3。
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施是升高温度、增大盐酸浓度、粉碎、搅拌等;
(2)在酸性条件下H2O2具有氧化性,可以把Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)沉镍前要将Fe3+、Al3+沉淀完全,而镍离子不能形成沉淀,根据溶液的pH与金属氢氧化物沉淀的关系表格数值可知:溶液的pH值控制在4.7≤pH<7.1;
(4)沉镍时Ni2+与CO32-形成NiCO3沉淀,反应的离子方程式为Ni2++CO32-=NiCO3↓;
(5)NaClO中Cl元素化合价为+1价,反应后变为NaCl中的-1价,Cl元素由+1价降为-1价,而Ni由反应前NiCl2中的+2价升高到Ni2O3中的+3价,根据电子守恒、电荷守恒及原子守恒,可得Ni2+氧化生成Ni2O3的离子方程式为:2Ni2++ClO-+4OH-=Ni2O3+Cl-+2H2O。


科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
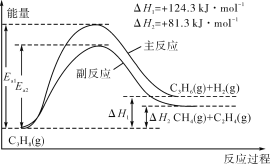
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__(填“增大”“减小”或“不变”,下同),转化率α(C3H8)__。
②温度升高,副反应更容易发生的主要原因是__。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是__(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__。
②298K时,该工艺总反应的热化学方程式为__。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关认识正确的是
A.各能级按![]() 、
、![]() 、
、![]() 、
、![]() 的顺序所容纳的最多电子数依次为1、3、5、7的2倍
的顺序所容纳的最多电子数依次为1、3、5、7的2倍
B.各能层的能级都是从![]() 能级开始至
能级开始至![]() 能级结束
能级结束
C.各能层含有的能级数为![]()
D.各能层含有的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是用不同方法表示的几种有机物:
① ②
②![]() ③
③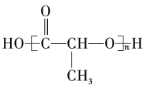 ④
④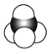
⑤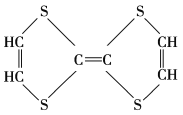 ⑥
⑥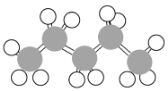
⑦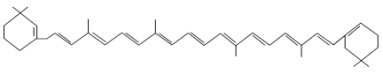
⑧
(1)上述表示方法中属于结构简式的为______(填序号,下同);属于结构式的为______;属于键线式的为______;属于比例模型的为______;属于球棍模型的为______。
(2)写出⑧中所含官能团的电子式:______、______。
(3)①的分子式为______,最简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在蒸馏烧瓶中加NaBr、适量水、95%的乙醇和浓硫酸,用酒精灯对烧瓶微热,边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。其中可能发生的副反应有:2HBr+H2SO4(浓)→Br2+SO2![]() +2H2O
+2H2O
完成下列填空:
(1)制备溴乙烷的化学方程式为:_________、_______。
(2)反应中加入少量水不能产生的作用是__________(选填编号)
A 防止溴乙烷被浓硫酸氧化 B 减少溴化氢的挥发
C 使反应混合物分层 D 溶解溴化钠
(3)为了保证容器均匀受热和控制恒温,加热方法最好采用________。
(4)采用边反应边蒸馏的操作设计,其主要目的是_________。
(5)溴乙烷可用水下收集法获得的依据是___________。
(6)下列装置在实验中既能吸收HBr气体,又能防止液体倒吸的是__________(选填编号)
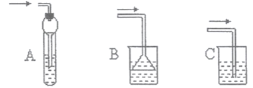
(7)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,可加入的试剂为________(选填编号)
A 碘化钾溶液 B 亚硫酸钠溶液 C 氢氧化钠溶液
(8)以下步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为
A.8:1B.2:1C.3:2D.2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________、________。
(2)写出Na2SO3固体氧化变质的化学方程式_____________。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________,
在过滤前,需要检验是否沉淀完全,其操作是______________。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________(填“偏高”或“偏低”)。
(5)若操作正确,则m1________m2(填“>”、“<”或“=”),原因是_______________。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________(注明表达式中所用的有关符号的含义和单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种烃的最简式相同,7.8gA完全燃烧后生成物通入过量的石灰水中,得到沉淀60g。既可以用酸性KMnO4溶液对A、B进行鉴别,也可以用溴水反应对它们进行鉴别。0.5mol B完全燃烧生成22.4LCO2(标准状况)和9g水,在相同状况下,A与B蒸气的密度比为3:1。试通过计算推断这两种烃的结构简式。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com