
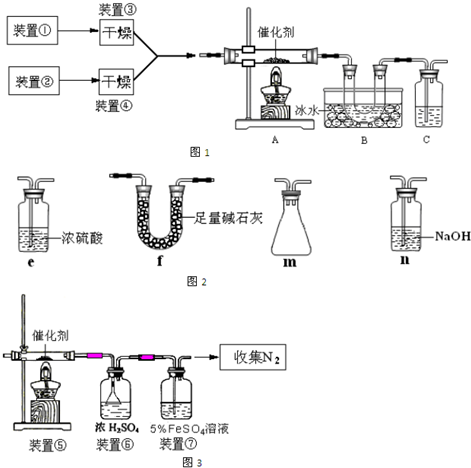
分析 (1)装置①用于实验室制备NH3,铵盐与碱加热制备;一氧化氮易被氧气氧化成红棕色的二氧化氮,所以B处冰水冷却的U型管中有红棕色气体生成,二氧化氮中存在一个平衡,会转化为无色的四氧化二氮,温度降低,平衡向正反应方向移动,所以U型管底部颜色越浅;
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,据此书写化学方程式;欲制得纯净干燥的SO3,若C中盛放NaOH溶液需将C装置换成f,或将e、m依次连接在B、C之间;
(3)硫酸亚铁吸收NO,Fe2++NO=Fe(NO)2+生成配合物;根据反应6NO+4NH3═5N2+6H2O计算NO的转化率.
解答 解:(1)装置①用于实验室制备NH3,化学反应为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,是因为A中产生了NO,2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,2NO+O2=2NO2,2NO2(红棕)?N2O4(无色);
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,+6铬变为产物中的+3价铬,二氧化硫中+4价的硫变为产物中+6价的硫,反应的离子方程式为Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O,欲制得纯净干燥的SO3,需用浓硫酸干燥需选e,不能选f,然后用m收集,将e、m依次连接在B、C之间或将C装置换成f,
故答案为:Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O;将e、m依次连接在B、C之间或将C装置换成f;
(3)装置①、装置②分别制NO和NH3,在⑤中二者发生氧化还原反应生成氮气,可能混有NO或氨气,⑥可吸收水或氨气,因一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为FeSO4+NO=Fe(NO)SO4,装置⑦的作用吸收未反应的NO;
在一定条件下反应中气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6 5
V 11.2L
$\frac{6}{5}$=$\frac{V}{11.2}$,解得V=13.44L,则NO的转化率为 $\frac{13.44L}{22.4L}$×100%=60%,
故答案为:吸收未反应的NO; 60%.
点评 本题考查性质实验方案的设计,为高频考点,把握反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度中等,注意常见气体的制备及性质.


科目:高中化学 来源: 题型:选择题
| A. | 平衡正向移动 | B. | 平衡逆向移动 | ||
| C. | 正逆反应速率都增大 | D. | NH3的质量分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、Ca2+、Cl-、NO3- | B. | Fe2+、H+、SO32-、ClO- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料符合绿色化学原子经济性要求 | |
| B. | 银制品久置干燥空气中因电化学腐蚀而使表面变暗 | |
| C. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| D. | 在合成洗涤剂中添加酶制剂可以提高洗涤效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com