

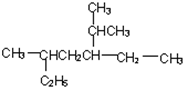
 2,5-二甲基-3-乙基-庚烷
2,5-二甲基-3-乙基-庚烷 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ .
. 分析 (1)离子化合物中阴离子写出电荷及电性并用“[]”括起来,阳离子写出电荷和电性即可,离子都满足8电子稳定结构;
(2)最长碳链为7个碳原子;
(3)有一种结构在和HBr加成时产物只有一种结构,说明结构对称;
(4)苯环能与氢气加成.
解答 解:(1)氯化钙为离子化合物,用电子式表示下列物质的形成过程为 ,故答案为:
,故答案为: ;
;
(2)最长碳链为7个碳原子, 名称为:2,5-二甲基-3-乙基-庚烷,故答案为:2,5-二甲基-3-乙基-庚烷;
名称为:2,5-二甲基-3-乙基-庚烷,故答案为:2,5-二甲基-3-乙基-庚烷;
(3)有一种结构在和HBr加成时产物只有一种结构,说明结构对称,结构简式是CH3CH=CHCH3,故答案为:CH3CH=CHCH3;
(4)苯环能与氢气加成,化学方程式 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ ,故答案为:
,故答案为: +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ .
.
点评 本题考查了烷烃的命名以及化学方程式的书写,题目难度中等,注意掌握常见有机物的命名原则,烷烃的命名中,正确选取最长碳链为主链是解题关键,试题培养了学生灵活应用所学知识的能力.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:解答题
 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下: +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$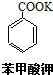 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O 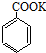 +HCl→
+HCl→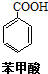 +KCl
+KCl| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
| 甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
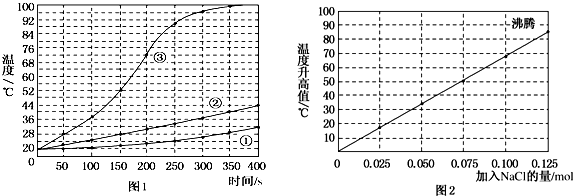
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改用20mL 18mol/L的H2SO4实验 | B. | 反应物中加入少量的硝酸钠固体 | ||
| C. | 反应物中加入少量的硫酸铜固体 | D. | 反应物中加入少量的碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池可在常温或高温时工作,对环境有较强的适应性 | |
| B. | 负极反应为H2+2OH--2e-=2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应2molH2O,同时转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:碘化氢>溴化氢>氯化氢 | B. | 氧化性:K+<Na+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 原子半径:钠>硫>氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸不能干燥碱性气体NH3,也不可干燥CO、H2等还原性气体 | |
| B. | 常温下,铜片和浓硫酸反应产生的气体可使晶红溶液褪色 | |
| C. | 浓硫酸与磁性氧化铁的反应只表现出浓硫酸的酸性 | |
| D. | 蔗糖与浓硫酸的实验过程及现象表现出浓硫酸具有吸水性、脱水性和强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com