
【题目】25 ℃时,将1.0 L w mol·L-1的CH3COOH溶液与0.1 mol的NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体。溶液pH随通(加)入HCl或NaOH的物质的量的变化如下图。下列叙述正确的是 ( )
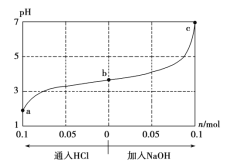
A.a、b、c对应的混合液中,水的电离程度由大到小的顺序是a>b>c
B.若忽略体积变化,则25 ℃时,CH3COOH的电离平衡常数K=![]() ×10-7 mol·L-1
×10-7 mol·L-1
C.加入NaOH过程中,![]() 逐渐减小
逐渐减小
D.加入NaOH过程中,c(Na+)·c(CH3COO-)逐渐减小
【答案】B
【解析】
A项,a、b对应的混合液显酸性,溶液中的![]() 主要来源于酸的电离,酸电离产生的
主要来源于酸的电离,酸电离产生的![]() 浓度越高,水的电离越抑制的程度越大;c对应的溶液呈中性,所以电离程度大小顺序应为:a<b<c,故A项错误;
浓度越高,水的电离越抑制的程度越大;c对应的溶液呈中性,所以电离程度大小顺序应为:a<b<c,故A项错误;
B项,分析图像最右端的c点,在此处![]() 为7,c(H+)=
为7,c(H+)=![]() 。已加入的
。已加入的![]() 物质的量为
物质的量为![]() ,溶液的体积为1L。溶液中原有的
,溶液的体积为1L。溶液中原有的![]() 物质的量为w mol,写出此时的电荷守恒式:
物质的量为w mol,写出此时的电荷守恒式:![]() ,又因为溶液呈中性,所以可以得
,又因为溶液呈中性,所以可以得![]() ,
,![]() ,所以
,所以![]() ,故B项正确;
,故B项正确;
C项,加入![]() 过程中,可知
过程中,可知![]() 的浓度和
的浓度和![]() 、
、![]() 的浓度均增大,
的浓度均增大,![]() 浓度减小,根据溶液电荷守恒
浓度减小,根据溶液电荷守恒![]() ,可知钠离子浓度增加大于醋酸根浓度增加,所以
,可知钠离子浓度增加大于醋酸根浓度增加,所以![]() 一定是增大的,故C项错误;
一定是增大的,故C项错误;
D项,加入![]() 过程中,可知
过程中,可知![]() 的浓度和
的浓度和![]() 、
、![]() 的浓度均增大,所以c(Na+)·c(CH3COO-)逐渐增大,故D项错误;
的浓度均增大,所以c(Na+)·c(CH3COO-)逐渐增大,故D项错误;
故答案选B。


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入A(体积不变)时混合物的颜色________,加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.金刚石的一个晶胞中含有6个碳原子。
B.12 g石墨中六元环的数目为0.5NA。
C.1个干冰晶胞的质量为![]() ×44 g。
×44 g。
D.以面心立方最密堆积形成的晶胞中金属含有4个金属原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 1.2 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 1.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
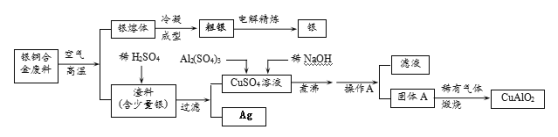
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
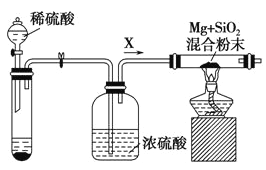
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20 g NaOH固体溶于水配成100 mL溶液,其密度为1.185 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为______mol·L-1。
(2)从该溶液中取出10 mL,其中NaOH的物质的量浓度为_____ mol· L-1,含NaOH的物质的量为______mol。
(3)将取出的10 mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1 mol·L-1,稀释后溶液体积为___ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
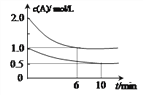
A. x=1
B. 此条件下,该反应的平衡常数K=4
C. 给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D. 甲和乙中B的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入500 mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距离刻度线l~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,反复上下颠倒摇匀。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号) _______________________;
(2)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有 ______________________;
(3)实验中称取NaCl晶体的质量是_________________g;
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”、“无影响”)
A、定容时俯视 _______________;
B、加蒸馏水时不慎超过了刻度 线________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com