
【题目】从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜的工艺流程如图:

(1)步骤(Ⅰ)“吹脱”的目的是___(写一条即可);由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的___(填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,目的是___。
(3)步骤(Ⅳ)反应中,氧化产物与还原产物的物质的量之比为___。
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为___,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为___。
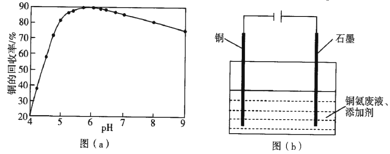
(5)“吹脱”后的铜氨溶液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生的电极方程式为___;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率,从环境角度考虑,较好的是___(填“NaCl”或“H2SO4”)。
(6)已知上述流程中只有步骤(Ⅲ)“沉铜”和步骤Ⅴ“制硫酸铜”中铜元素有损耗。步骤(Ⅲ)“沉铜”时铜元素的损耗率为4%;步骤Ⅴ“制硫酸铜”时铜元素损耗率为2%。若1L废液最终制得CuSO45H2O375g,则1L废液中含有铜元素的质量为___g。(保留整数)
【答案】将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化并以CO2吹出、吹出游离的NH3等 强 使Cu2+尽可能沉淀完全,降低残留率 3:2 2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+ 6(或5.56.5) [Cu(NH3)4]2++2e=Cu+4NH3 H2SO4 102
【解析】
从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO32-等中回收铜,废液中通入热空气,并加热,可生成二氧化碳、氨气,得到含有[Cu(NH3)4]2+、CH3COO-、CO32-的溶液,加入20%的硫酸,调节pH=2,得到硫酸铜、硫酸铵溶液,加入20%的硫化钠溶液生成CuS沉淀,在沉淀中加入硝酸可生成NO、S和硝酸铜,加入硫酸生成硫酸铜,经蒸发晶体得到无水硫酸铜晶体;[Cu(NH3)4]2+、CH3COO-、CO32-的溶液加入盐酸,经过滤、洗涤、干燥,可得到碱式氯化铜,以此解答该题。
(1)步骤(Ⅰ)“吹脱”时通入空气,氧气可将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化生成CO2吹出、吹出游离的NH3等,步骤(Ⅱ)加入硫酸生成硫酸铵,可确定NH3与H+的结合能力比与Cu2+的强,故答案为:将Cu(Ⅰ)氧化为Cu(Ⅱ)、将CO氧化并以CO2吹出、吹出游离的NH3等;强;
(2)步骤(Ⅲ)“沉铜”时,Na2S的用量比理论用量多,可使Cu2+尽可能生成CuS沉淀,可降低残留率,故答案为:使Cu2+尽可能沉淀完全,降低残留率;
(3)CuS与硝酸反应生成NO、S,反应中S元素化合价由2价升高到0价,N元素化合价由+5价降低为+2价,则氧化产物与还原产物的物质的量之比为3:2,故答案为:3:2;
(4)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+,由图可知为尽可能提高铜的回收率,需控制的pH约为6(或5.56.5),故答案为:2[Cu(NH3)4]2++Cl+5H++3H2O=Cu2(OH)3Cl↓+8NH4+;6(或5.56.5);
(5)阴极主要发生反应的电极反应式为[Cu(NH3)4]2++2e=Cu+4NH3,如加入盐酸,则阳极发生氧化反应生成氯气,污染空气,从环保的角度可知,应加入硫酸,故答案为:[Cu(NH3)4]2++2e=Cu+4NH3;H2SO4;
(6)375gCuSO45H2O中Cu的质量=375g×![]() ÷(12%)÷(14%)=102g,故答案为:102。
÷(12%)÷(14%)=102g,故答案为:102。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.pH=2的溶液:Na+、Fe3+、Cl-、NO3-
B.c(NaAlO2)=0.1mol·L-1的溶液:K+、H+、Cl-、SO42-
C.c(OH)<![]() 的溶液:Na+、K+、SiO32-、ClO-
的溶液:Na+、K+、SiO32-、ClO-
D.c(Fe3+)=0.1mol·L-1的溶液:Al3+、NO3-、MnO4-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷晶体的晶胞结构如图所示,下列说法正确的是( )

A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有12个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 已知HI(g) ![]() 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.可以通过沉淀反应使杂质离子完全沉淀
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的物质的量分数与溶液pH的关系如图乙所示,则下列说法中正确的是( )
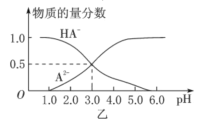
A.pH=4.0时,图中n(HA-)约为0.0091mol
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
D.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如图所示:
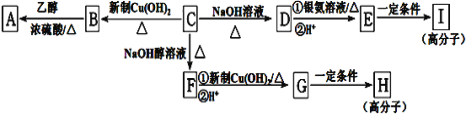
(1)C的结构简式是_____。
(2)E中含氧官能团的名称是______;C→F的反应类型是_____。
(3)写出下列化学方程式:G在一定条件下合成H的反应______。
(4)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有_____种,写出其中核磁共振氢谱有4个吸收峰的结构简式_____。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。

请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为____________,Ni在元素周期表中处于第____________纵行。
(2)C、N、O三种元素中电负性最大的是____(填元素符号),C在形成化合物时,其键型以共价键为主,原因是_____________。
(3)Ni(NO3)2中阴离子的空间构型是______,写出与该阴离子互为等电子体的一种分子的化学式:________。
(4)一维链状配位聚合物中,碳原子的杂化形式为________________________。
(5)已知: CH3COOH的沸点为117.9℃, HCOOCH3的沸点为32℃,CH3COOH的沸点高于 HCOOCH3的主要原因是______。
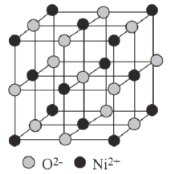
(6)已知:氧化镍的晶胞结构如图所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为____pm(用含ρ、NA的代数式表示)。
②某缺陷氧化镍的组成为 Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com