
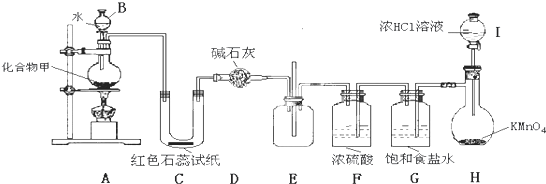
| 1.12L |
| 22.4L/mol |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学卷(7、8班)(带解析) 题型:填空题
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题: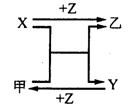
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为 ,乙的电子式为 。
(2) 若X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂,甲的电子式 ,乙的化学式为 。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y原子基态电子排布式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江嵊泗中学高二下学期第二次月考化学卷(7、8班)(解析版) 题型:填空题
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题:

(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为 ,乙的电子式为 。
(2) 若X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂, 甲的电子式 ,乙的化学式为 。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y原子基态电子排布式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表给出了六种元素的相关信息,其中A、B、C、D、E、F为短周期元素,原子序数依次递增。
| 元素 | 相关信息 |
| A | 单质为密度最小的气体 |
| B | 元素最高正价与最低负价之和为0 |
| C | |
| D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
| E | 存在质量数为23,中子数为12的核素 |
| F | 单质F为淡黄色固体 |
根据上述信息填空:
(1)元素D在元素周期表中的位置是 。BD2由固态变为气态所需克服的微粒间作用力是 。
(2)化合物甲是一种强氧化剂,由元素D和E组成,写出一种甲的用途: ,
书写化合物甲与BD2的反应式并标出电子转移情况: 。
(3)化合物乙由元素D和F组成,气体乙与A2F反应的化学方程式是 。
化合物乙的危害 。(写一种)
(4)书写铜与C的高价含氧酸的稀溶液反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com