
【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
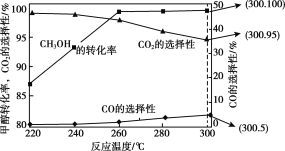
从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。
【答案】400 97.56% CH3OH(g)![]() CO(g)+2H2(g) △H=+90kJ·mol-1 260℃ 反应i CO2+6e-+6H+=CH3OH+H2O
CO(g)+2H2(g) △H=+90kJ·mol-1 260℃ 反应i CO2+6e-+6H+=CH3OH+H2O
【解析】
(1)由表格可知,10min后,反应达到了平衡,根据 ,求平衡常数,根据
,求平衡常数,根据![]() ,求甲醇的平衡转化率;
,求甲醇的平衡转化率;
(2)①根据盖斯定律i+ii可得:CH3OH(g)![]() CO(g)+2H2(g),△H=△H1+△H2,据此求出△H;
CO(g)+2H2(g),△H=△H1+△H2,据此求出△H;
②由图可知,低于260℃时,CH3OH的转化率较低,高于260℃时,CH3OH的转化率较高,但在高于260℃时,CO的选择性逐渐增大,CO2的选择性逐渐减小。
③ CO2在酸性环境下,电解生成甲醇,二氧化碳得到电子,发生还原反应,生成甲醇,电极反应式为:CO2+6e-+6H+=CH3OH+H2O;
(1)由表格可知,10min后,反应达到了平衡,根据反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g), ;设甲醇的起始为xmol/L,根据三段式:
;设甲醇的起始为xmol/L,根据三段式:
2CH3OH (g) ![]() CH3OCH3 (g) + H2O (g)
CH3OCH3 (g) + H2O (g)

x=(1.6+0.04)mol/L=1.64mol/L,则![]() ,故答案为:400;
,故答案为:400;![]() ;
;
(2)① 反应i:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H1=+49kJmol-1;反应ii:H2(g)+CO2(g)
CO2(g)+3H2(g) △H1=+49kJmol-1;反应ii:H2(g)+CO2(g)![]() CO(g)+H2O(g) △H2=+41kJmol-1;根据盖斯定律i+ii可得:CH3OH(g)
CO(g)+H2O(g) △H2=+41kJmol-1;根据盖斯定律i+ii可得:CH3OH(g)![]() CO(g)+2H2(g),△H=△H1+△H2=49kJmol-1+41kJmol-1=+90kJ·mol-1,故答案为:CH3OH(g)
CO(g)+2H2(g),△H=△H1+△H2=49kJmol-1+41kJmol-1=+90kJ·mol-1,故答案为:CH3OH(g)![]() CO(g)+2H2(g) △H=+90kJ·mol-1。
CO(g)+2H2(g) △H=+90kJ·mol-1。
②由图可知,低于260℃时,CH3OH的转化率较低,高于260℃时,CH3OH的转化率较高,但在高于260℃时,CO的选择性逐渐增大,CO2的选择性逐渐减小,所以最适宜温度为260℃;随着温度的升高,催化剂对CO的选择性增大,CO2的选择性减小,所以温度升高,催化剂对反应i的选择性越低,故答案为:260℃;反应i。
③ CO2在酸性环境下,电解生成甲醇,二氧化碳得到电子,发生还原反应,生成甲醇,其电极反应式为:CO2+6e-+6H+=CH3OH+H2O,故答案为:CO2+6e-+6H+=CH3OH+H2O。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】取100.0 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到16.84g沉淀,用过量稀硝酸处理后沉淀质量减少至6.99g,同时溶液中有气泡产生。试求:
(1)原混合液中Na2SO4的物质的量浓度为_____;
(2)产生的气体在标准状况下的体积为多少__________?(要求写出计算过程,只写结果不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式不正确的是( )
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向NaHCO3溶液中加入过量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。
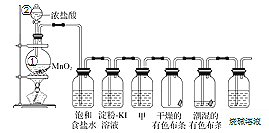
请按要求回答下列问题:
(1)仪器②的名称___________,①中反应的离子方程式__________
(2)浓盐酸的作用_______、______________,饱和食盐水的作用__________
(3)淀粉KI溶液中观察到的现象是______________,反应的离子方程式为________。
(4)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是________(填名称)。
(5)Cl2与烧碱溶液反应制取84消毒液的化学方程式为________。
(6)该兴趣小组用0.2mol 二氧化锰与足量的浓盐酸制备氯气,则理论上最多可制得氯气的质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些行业的废水中氨氮含量严重超标,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点,有多种方法可以去除。
I.电镀行业废水处理流程如图:
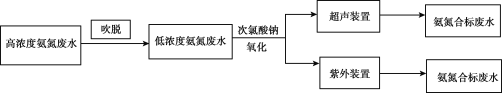
(1)吹脱法除氨氮:水中的氨氮大多数以NH4+和游离态的NH3保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移。从而达到脱除氨的目的。氨氮废水中NH3和NH4+平衡态的平衡关系有___。
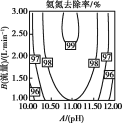
(2)温度、pH值、空气流量对脱除氨有很大的影响。pH值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,10<pH<11时,吹脱率随着pH增加而增加,请用化学平衡移动原理解释原因___。
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是___。
II.对于含有H2PO4-的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生OH-,在通入O2的情况,又产生H2O2,以氧化水中的NH4+,同时NH4+还可以通过生成MgNH4PO46H2O沉淀而持续被除去。
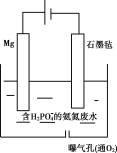
(1)阳极的电极反应式是___。
(2)废水中的NH4+'转化为MgNH4PO46H2O的离子方程式是___。
(3)pH大于10.5不利于MgNH4PO46H2O的生成,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物,说法不正确的是
A.氮气是空气中含量最高的气体,性质比较稳定
B.人工固氮需要在高温高压催化剂的条件下进行,但这是个放热反应
C.工业硝酸往往会发黄,因为其中含有Fe3+
D.常温下,浓硝酸可以利用铁罐车进行运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个相同带活塞的容器,向容器a中充入NO2(g)待颜色不再变化,再向容器b中充入溴蒸汽,使两容器的颜色和体积相等〔注意:同浓度的NO2和Br2蒸汽颜色相同,2NO2(g)![]() N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是
N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是

A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅
B.若对a和b以极慢的速度缓缓压缩,则a和b的颜色均慢慢加深,但在每一个相同的时间点,b的颜色总比a的深
C.假设容器和活塞均为无色,从容器左侧观察a和a′,a′的颜色比a浅
D.气体的物质的量:na一定大于nb′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池是一种可充放电池,电池反应为2Li + O2 = Li2O2,某锂-空气电池的构造原理图如下。下列说法正确的是
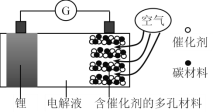
A.可选用有机电解液或水性电解液
B.含催化剂的多孔电极为电池的负极
C.放电时正极的电极反应式为O2 + 2Li+ + 2e-= Li2O2
D.充电时锂电极应连接外接电源的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com