
【题目】(1)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10 (g) + 1/2O2 (g)= C4H8 (g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g) + 1/2O2(g)= H2O(g) ΔH3=242kJ·mol1
反应①的ΔH1为________kJ·mol1。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是_______________________________。
(3)对于可逆反应C(s) + H2O(g) ![]() CO(g) + H2(g), ΔH>0,达到平衡后,改变条件对平衡有何影响,回答下列问题:
CO(g) + H2(g), ΔH>0,达到平衡后,改变条件对平衡有何影响,回答下列问题:
①升高温度,平衡__________移动(填“正反应方向”“逆反应方向”或“不”,下同)。
②加入固体碳,平衡________移动。
③加入水蒸气,平衡_________移动。
④扩大容器体积,平衡_________移动。
【答案】+123kJ·mol1取少量待测液于试管中,滴加几滴酸性高锰酸钾溶液,若溶液紫色褪去,证明原溶液中含有Fe2+,反之,没有Fe2+正反应方向不正反应方向正反应方向
【解析】
(1)根据盖斯定律,②式-③式可得①式的△H1;
(2)检验硫酸铁溶液中是否存在Fe2+的方法是利用亚铁离子的还原性。
(3)①该反应为吸热反应;
②C为纯固体;
③加入水蒸气,反应物浓度增大;
④该反应为气体体积增大的反应,扩大容器体积,压强减小.
(1)已知:②C4H10 (g) + 1/2O2 (g)= C4H8 (g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g) + 1/2O2(g)= H2O(g) ΔH3=242kJ·mol1
②-③得C4H10(g)=C4H8(g)+H2(g)△H1=+123kJ·mol-1
(2)检验硫酸铁溶液中是否存在Fe2+的方法是: 取少量待测液于试管中,滴加几滴酸性高锰酸钾溶液,若溶液紫色褪去,证明原溶液中含有Fe2+,反之,没有Fe2+。
(3)①该反应为吸热反应,升高温度,平衡向正反应方向移动;
②C为纯固体,则加入固体碳,平衡不移动;
③加入水蒸气,反应物浓度增大,平衡向正反应方向移动;
④该反应为气体体积增大的反应,扩大容器体积,压强减小,平衡向正反应方向移动.


科目:高中化学 来源: 题型:
【题目】下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
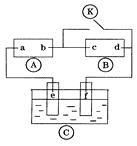
A. a为直流电源的负极
B. c极发生的反应为2H++2e-=H2↑
C. f电极为锌板
D. e极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
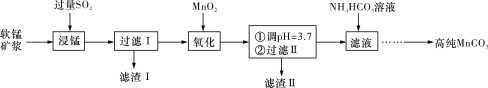
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
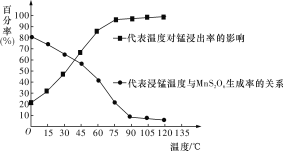
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2A(g)+B(g)![]() 2C(g)
2C(g)
(1)在一个体积为2L的密闭容器中充入6 mol A和3mol B进行上述反应,保持温度不变,2min后达到平衡,测得混合气体中B的体积分数为25%,用A浓度变化表示的化学反应速率为___________,求该温度下平衡常数K=______________;
(2)下图表示在密闭容器中上述反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a~b过程中改变的条件可能是________;b~c过程中改变的条件可能是________;请将增大压强时,反应速度变化情况画在c~d处。____________
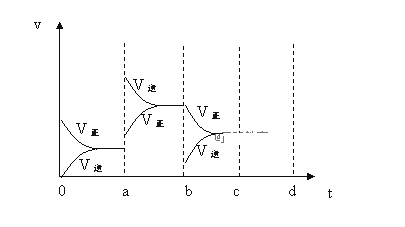
(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡后,容器内温度将______(填“升高”、“降低”或“不变”(假设容器不与外界进行热交换))。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应X(g)![]() 4Y(g)+Z(g),在200℃和T℃时,X 的物质的量浓度(单位:mol·L-1)随时间变 化的有关实验数据见下表:
4Y(g)+Z(g),在200℃和T℃时,X 的物质的量浓度(单位:mol·L-1)随时间变 化的有关实验数据见下表:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
200/℃ | 0.80 | 0.55 | 0.35 | 0.20 | 0.15 | 0.15 |
T/℃ | 1.00 | 0.65 | 0.35 | 0.18 | 0.18 | 0.18 |
下列有关该反应的描述正确的是
A. 在200℃时,4min内用Y表示的化学反应速率为0.1125mol·L-1·min-1
B. T℃下,6min时反应刚好达到平衡状态
C. 根据上表内 X 的浓度变化,可知浓度越大,反应速率越大
D. 从表中可以看出T <200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.Cl2的水溶液能导电,但Cl2是非电解质
C.盐酸能导电,故盐酸是电解质
D.硫酸钡难溶于水,但硫酸钡是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是 ( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是 ( )

A. 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
B. 从反应开始到平衡,H2的平均反应速率v(H2)=0.225 mol·L-1·min-1
C. 13min时,向容器中充入2 mol氦气,该反应的化学反应速率增加
D. 13min时,向容器中充入2 mol氦气,CO2的转化率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com