
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 操作 | 现象 |
 | 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
| A. | 烧杯A中发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 红棕色气体消失只与NO2和烧杯C中的KI发生反应有关 | |
| C. | 烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关 | |
| D. | 若将铜片换成铁片,则C中的液体也可能变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
查看答案和解析>>
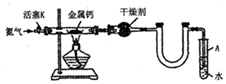
科目:高中化学 来源: 题型:解答题
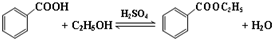
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

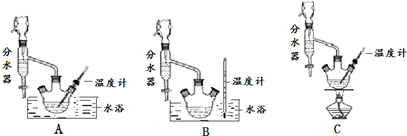
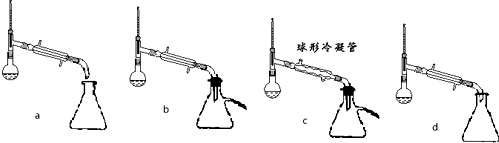
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com