
| A. |  摇匀 | B. | 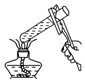 给溶液加热 | C. |  滴加液体 | D. |  过滤 |
分析 A.配制一定浓度溶液时,需要通过上下颠倒振荡;
B.试管中液体体积不能超过试管容积的三分之一;
C.胶头滴管的下端不能插入试管中;
D.过滤时,分液漏斗下端必须紧靠烧杯内壁.
解答 解:A.图示采用上下颠倒振荡,该操作方法合理,故A正确;
B.给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的三分之一,图中液体超过试管容积的三分之一、故B错误;
C.用胶头滴管滴加液体时,滴管不能伸入试管中,否则会污染试剂,图示侧重不合理,故C错误;
D.过滤液体时,要注意“一贴、二低、三靠”的原则,图示装置中分液漏斗下端没有紧靠烧杯内壁,该侧重不合理,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及溶液配制、试管、胶头滴管的使用方法等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
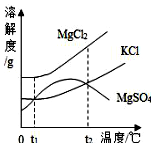 海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )
海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )| A. | t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2 | |
| B. | t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和 | |
| C. | t2℃时,KCl和MgSO4两种物质的溶解度相同 | |
| D. | 将卤水加热到t2℃以上,析出的晶体主要为MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、H2SO4、MgCl2 | B. | NaCl、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 油脂和蛋白质都属于高分子化合物 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
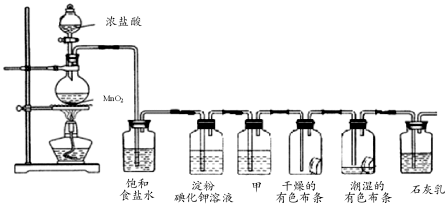
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.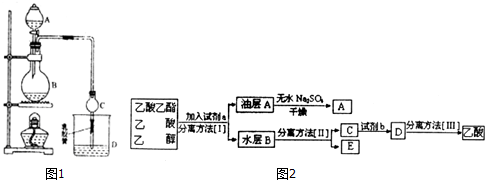
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com