
【题目】已知:830℃,在一个密闭容器中发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
A. v正= v逆B. v正> v逆C. v正< v逆D. 无法确定
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g)![]() 2Z(g) △H=-92kJ/mol,将1mol X和3mol Y通入2L的恒容密闭容器中进行反应,10min时测得Y的物质的量为2.4mol。下列说法正确的是
2Z(g) △H=-92kJ/mol,将1mol X和3mol Y通入2L的恒容密闭容器中进行反应,10min时测得Y的物质的量为2.4mol。下列说法正确的是
A.10min内,X的平均反应速率为0.01mol/(L·min)
B.第10min时,X的反应速率为0.01mol/(L·min)
C.10min内,消耗0.1mol X,生成0.4mol Z
D.10min内,X和Y反应放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异秦皮啶具有镇痛、安神、抗肿瘤的功效,秦皮素具有抗痢疾杆菌的功效,它们在一定条件下可相互转化(如下图所示),下列有关说法正确的是( )

A. 异秦皮啶转化为秦皮素属于取代反应
B. 异秦皮啶与秦皮素互为同系物
C. 鉴别异秦皮啶与秦皮素可用FeCl3溶液
D. 1 mol秦皮素最多可与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2O2与H2O的反应,进行了如下实验:
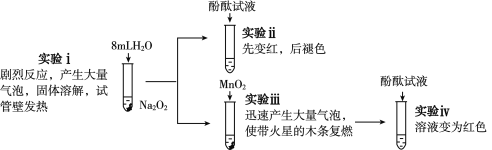
有关说法不正确的是( )
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑
B.实验ⅲ中MnO2做H2O2分解反应的催化剂
C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成
D.综合实验ⅱ和ⅲ可以说明使酚酞褪色的是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了测定工业纯碱的纯度,进行了一系列实验。
(1)和索氏制碱法相比,侯氏制碱法的优势有___________________________________;
(2)工业纯碱中常含有少量NaCl杂质,解释原因__________________________,检验是否含有氯化钠杂质的方法为__________________________________________________________;
(3)使用重量法测定纯碱的纯度,用到的试剂有__________________________________;
(4)使用滴定法测定纯碱的纯度,用_________________(填仪器名称)称量1.200g工业纯碱样品,溶解,用1mol/L盐酸做标准液,滴定过程中溶液pH变化和生成CO2的量如图所示,A点溶液呈碱性的原因______________________________________________________,计算该工业纯碱样品的质量分数_______________。(计算结果保留两位小数)
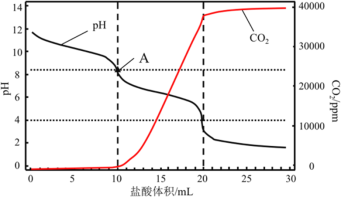 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。
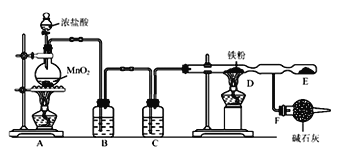
(1)写出A中反应的化学方程式:_______________________________________。
(2)装置B、C中应盛放的试剂名称分别为_____________、_____________;
(3)实验时,先点燃______________处的酒精灯, F装置所起的作用是:__________(答两点)。
(4)用石灰乳吸收氯气可制得漂白粉,写出工业制漂白粉的化学方程式: ______________,长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
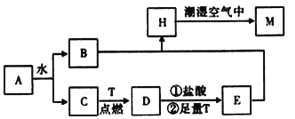
(1)物质D的化学式为 ________。
(2)A和水反应生成B和C的离子方程式为____________________,列出A的一种重要用途_________________。
(3)H在潮湿空气中变成M的实验现象是______________________。
(4)反应①的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
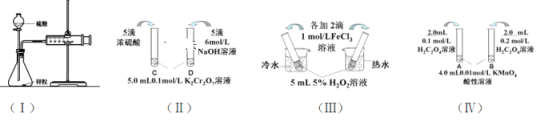
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。①此方法需要控制的变量有(至少写出两项):___。②为了衡量反应的快慢,还可以采用新的测定方法是_____。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
2CrO42-(黄色)+ 2H+。D试管中实验现象为_______________________________,用平衡移动原理解释原因:_______________________
(3)实验(Ⅲ)①实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)①实验目的是_____。②溶液褪色的时间:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的氯气通入100mL4mol·L-1的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )
A.当通入的Cl2为2.24L时,反应中电子转移数目为0.1NA
B.当电子转移数目为0.2NA时,溶液质量增加14.2g
C.当溶液中Na+为0.4NA时,溶液中的Cl-为0.2NA
D.当溶液质量增加7.1g时,溶液中ClO-为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com