
| 催化剂 |
| △ |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
| 压强(MPa) 氨的平衡含量(%) 温度(摄氏度) |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
 ;
; ;
;| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
|
衡含量(%) 温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
回答下列有关问题:
(1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。
(2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。
(3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
| 反应速率 | 平衡常数K | 氨的体积分数 | |
| 变化情况 |
(4)将1molH2和1molN2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,测得NH3的物质的量为0.3mol,此时若移走0.5molH2和0.5molN2,则反应达到新的平衡时,NH3的物质的量为_____________(选填答案编号)。
A.0.3mol B.0.15mol C.小于0.15mol D.大于0.15mol,小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
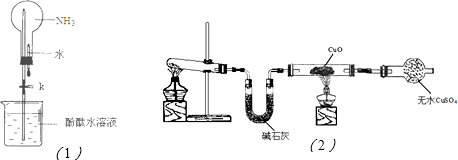
(16分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室制取氨气的化学方程式是 。
(2)①右图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
②氨气使烧杯中溶液由无色变为红色,其原因是_______________________________(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③该装置存在明显缺陷,请指出存在的问题并提出改进意见
。
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+Cu + Cu2+)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
;
(5)工业废气中的氮氧化物是主要的大气污染物之一。为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2 。现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省八校高三第一次联考(12月)理综化学试卷(解析版) 题型:填空题
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐 和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
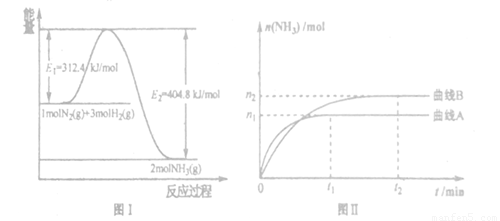
下列说法正确的是_______。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 mol/(L·min)
mol/(L·min)
(3) —定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时 测得容器的压强为起始时的 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(4)已知H2(g)的燃烧热为285.8 kJ/mol,试写出表示NH3(g)燃烧热的热化学反应方程式 _____。以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为_______经測定,该电作过程中每放出1 mol N2实际提供460 kJ的电能,则该燃料电池的实际效率为_____(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数)
查看答案和解析>>
科目:高中化学 来源:北京市顺义区2010年高三一模(理科综合)化学部分 题型:实验题
(16分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室制取氨气的化学方程式是 。
(2)①右图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
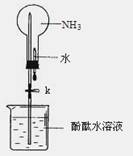
②氨气使烧杯中溶液由无色变为红色,其原因是_______________________________(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。

① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③该装置存在明显缺陷,请指出存在的问题并提出改进意见
。
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。
Cu + Cu2+)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
;
(5)工业废气中的氮氧化物是主要的大气污染物之一。为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2 。现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com