
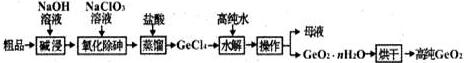
分析 (1)主族元素锗与碳、硅同主族.
(2)GeO2溶于强碱溶液,生成锗酸盐;As2O3类似氧化铝,与氢氧化钠反应生成NaAsO2.
(3)将粗品直接加入盐酸,生成氯化物GeCl4、AsCl3,从已知条件给出的沸点看出,不便分离.
(4)教材上的蒸馏实验用到的蒸馏烧瓶、冷凝器.对比可知工业上与蒸馏操作相关的设备.
(5)根据前面反应得到的锗酸盐以及蒸馏加的盐酸,目标产物是GeCl4 ,根据化合价不变,再写出反应.
(6)温度与化学平衡常数的关系;另外考虑氯化物的沸点低,高温易挥发.
(7)被除掉杂质的质量除以杂质的总质量就可得到杂质脱除率.
解答 解:(1)第ⅣA族主族元素有碳、硅、锗、锡、铅,所以锗在第四周期第ⅣA族.
故答案为:第四周期第ⅣA族
(2)从后面的工艺可知碱浸过程中的化学反应化合价是没有改变的.硅与锗同主族,二氧化硅与强碱反应生成硅酸盐和水,GeO2溶于强碱溶液,生成锗酸盐和水,其中锗的化合价是+4价,类似Na2CO3、Na2SiO3;
As2O3类似氧化铝,氧化铝与氢氧化钠反应生成偏铝酸钠(NaAlO2)和水,As2O3与氢氧化钠反应生成亚砷酸钠(NaAsO2)和水,
故答案为:GeO2+2NaOH═Na2GeO3+H2O As2O3+2NaOH═2NaAsO2+H2O
(3)将粗品直接加入盐酸,生成氯化物GeCl4、AsCl3氯,化物的沸点都较低,从已知条件也能看出,不便分离.也就是馏出物中将会含有AsCl3,降低了产品纯度.
故答案为:馏出物中将会含有AsCl3,降低了产品纯度.
(4)教材上的蒸馏实验用到的蒸馏烧瓶、冷凝器.工业上与蒸馏操作相关的设备有蒸馏釜、冷凝塔.所以选择A、C.
故答案为:AC
(5)根据前面反应得到的锗酸盐以及蒸馏加的盐酸,这些是反应物,目标产物是GeCl4 ,化合价不变,推出另外的产物为氯化钠和水.
故答案为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O
(6)温度对化学平衡的影响是降温向放热方向移动,说明水解方向为放热,温度较低时反应平衡常数较大,反应物平衡转化率更高;另外是考虑氯化物的沸点低,高温易挥发降低产率.
故答案为:该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率.
(7)1吨二氧化锗粗品(含杂质30%),二氧化锗的质量是0.7吨,杂质总质量0.3吨,经提纯得到0.724吨产品,说明还有杂质0.024吨,杂质脱除了0.276吨,杂质脱除率是:被除掉杂质的质量除以杂质的总质量,即$\frac{0.276}{0.3}$×100%=92%.
故答案为:92%
点评 除第一小题外,其余各小题都有一定难度,比如第2、4小题,考查物质性质相似性,化学类推思维,教材迁移能力,第5小题是陌生化学方程式的书写,还有第6、7小题需要学生有应变能力,学习化学实际处理问题的能力.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/l的NaAlO2溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
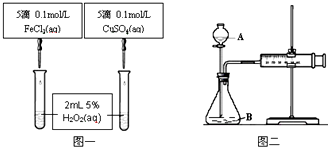
| A. | 图一可通过观察实验现象定量比较反应速率的大小 | |
| B. | 将CuSO4改为CuCl2更为合理 | |
| C. | 无法检查图二装置的气密性 | |
| D. | 图二所示实验中只需测量的数据是气体体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a极附近溶液呈红色 | |
| B. | a极电极反应方程式是:2H++2e-=H2↑ | |
| C. | b极附近溶液呈蓝色 | |
| D. | 溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | B. | $\frac{c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | ||
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+})•c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸可用于清除水垢 | B. | 蛋白质遇碘水显蓝色 | ||
| C. | 液化石油气的主要成份为CH4 | D. | 煤的液化属于物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com