
| A. | 将饱和FeCl3溶液逐滴滴加到NaOH溶液中,即可制得Fe(OH)3胶体 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体是带正电荷的 | |
| C. | 可利用丁达尔现象区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 将500mL 2mol/L FeCl3溶液制成胶体,胶粒的数目为NA |
分析 A.氯化铁溶液滴入氢氧化钠溶液生成氢氧化铁沉淀;
B.胶体是电中性分散系;
C.丁达尔现象是胶体的特性;
D.胶体粒子是微粒的集合体.
解答 解:A.反应生成沉淀,而实验室制备氢氧化铁胶体是把饱和氯化铁溶液滴入沸水中加热到呈红褐色液体,即得到氢氧化铁胶体,故A错误;
B.FeCl3溶液是电中性的,Fe(OH)3胶体不带电荷,胶体微粒吸附带电离子,故B错误;
C.丁达尔现象是胶体所特有的现象,可利用丁达尔现象区别FeCl3溶液和Fe(OH)3胶体,故C正确;
D.将500mL 2mol/L FeCl3溶液制成胶体,胶粒是氢氧化铁的集合体,所含胶粒的数目小于NA,故D错误;
故选C.
点评 本题考查了胶体的性质,题目难度不大,侧重于基础知识的考查.


科目:高中化学 来源: 题型:选择题
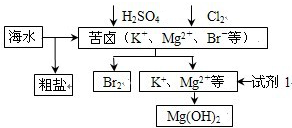
| A. | 试剂1可以选用石灰乳 | |
| B. | 从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=2 Cl-+Br2 | |
| C. | 工业上,电解熔融MgO冶炼金属镁可减小能耗 | |
| D. | 粗盐经提纯后可用于制备氯气、钠等产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C为不同核素 | |
| B. | 石墨和C60的互为同素异形体 | |
| C. | H2O和D2O互为同位素 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
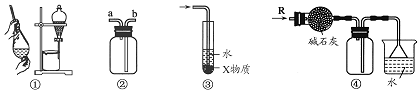
| A. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
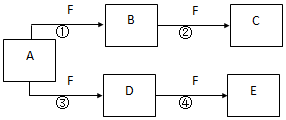 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题: ,A的电子式为
,A的电子式为 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
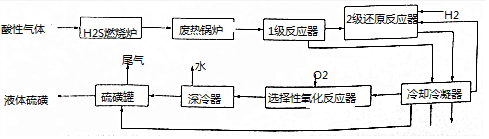
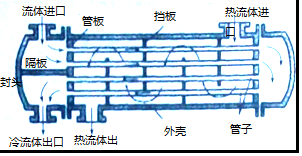
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
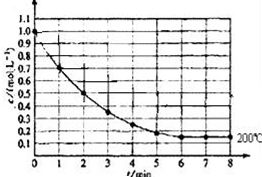 一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| B. | 在标况下,22.4LHF和22.4LC2H4原子个数比为1:3 | |
| C. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
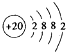 .其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).
.其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).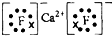 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com