
| A. | 2Q1+Q2>4Q3 | |
| B. | Q1+Q2<Q3 | |
| C. | 1mol氧气和2mol氢气的总能量高于1mol水的总能量 | |
| D. | 1mol氧气和2mol氢气的总能量低于1mol水的总能量 |
分析 化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能-生成物总键能,放热反应的△H<0,放热反应中反应物的总能量高于生成物的总能量,据此计算.
解答 解:破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,破坏1molO═O键消耗的能量为Q2kJ,则O═O键键能为Q2kJ/mol,
形成1molO-H化学键释放的能量为Q3KJ,则H-O键能为Q3kJ/mol,
反应热△H=2Q1kJ/mol+Q2kJ/mol-4×Q3kJ/mol=(2Q1+Q2-4Q3)KJ/mol,
由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-4Q3)<0,所以2Q1+Q2<4Q3,
放热反应中反应物的总能量高于生成物的总能量,即1mol氧气和2mol氢气的总能量高于1mol水的总能量;
故选C.
点评 本题考查反应热的计算,题目难度不大,注意从物质能量、键能角度理解反应热,明确反应热的焓变△H=反应物总键能-生成物总键能及焓变的正负与吸收、放热热量的关系.


科目:高中化学 来源: 题型:选择题
| A. | 在已知元素中具有最大的原子半径 | B. | 在空气中燃烧时生成氧化物Fr2O | ||
| C. | 氧化物对应的水化物是弱碱 | D. | 其单质的熔点比金属钠的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
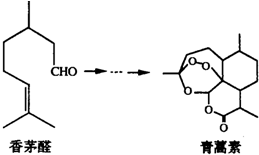
| A. | 青蒿素易溶于水,更易溶于乙醇等有机溶剂中 | |
| B. | 向香茅醛中滴加溴水后溴水褪色,证明香茅醛中含有碳碳双键 | |
| C. | 香茅醛与青蒿素均能发生氧化、取代、加成、聚合反应 | |
| D. | 香茅醛的同系物中,含4个碳原子的有机物有3种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | G元素的单质不存在同素异形体 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到均匀的紫色溶液 | B. | 无色水层下有橙红色液体 | ||
| C. | 无色水层下有紫色油状液体 | D. | 无色水层上有紫色油状液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com