
在含有Fe3+、Fe2+、Al3+、NH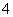 的稀溶液中加入足量Na2O2固体,充分反应后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
的稀溶液中加入足量Na2O2固体,充分反应后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Al3+
C.Fe2+、NH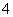 D.Fe3+
D.Fe3+
科目:高中化学 来源: 题型:
下图装置中X和Y均为石墨电极,电解液为500 mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。下列有关说法中不正确的是( )
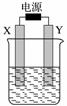
A.X电极是阴极
B.Y电极产生气体的体积为0.28 L
C.电解后溶液的pH=1
D.要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列试剂中,不能使Fe2+转化为Fe3+的是( )
①氯气 ②NaCl溶液 ③KMnO4溶液 ④稀硝酸 ⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④ C.②④⑤ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是
________________________________________________________________________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S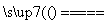 6Cu+SO2↑,反应的氧化剂是______________。
6Cu+SO2↑,反应的氧化剂是______________。
(3)SO2尾气直接排放到大气中造成环境污染的后果是__________________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称____________。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
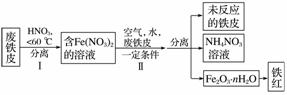
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为___________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
________________________________________________________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是( )
A.冶炼铁的主要原料有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿石中的脉石(二氧化硅)
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.工业上Mg可由电解熔融的MgO制取,Na也可由电解熔融的NaCl制取
D.铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是 ( )。
①能发生酯化反应的酸一定是羧酸 ②油脂水解后得到的醇是丙三醇 ③葡萄糖是最重要、最简单的糖 ④淀粉、纤维素、油脂都是高分子化合物 ⑤蛋白质溶液中加入K2SO4溶液后,蛋白质从溶液中析出,这种变化叫变性
A.③ B.③④
C.②③ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是:CH4+10OH--8e-===CO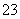 +7H2O;另一极通入O2。下列叙述不正确的是 ( )。
+7H2O;另一极通入O2。下列叙述不正确的是 ( )。
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时,溶液中的OH-向负极移动
D.该电池使用一段时间后应补充KOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com