
在醋酸中存在电离平衡:CH3COOH  CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
| A.加水 | B.加热 | C.加CH3COONa固体 | D.加很稀的NaOH溶液 |
BC
解析试题分析:在醋酸中存在电离平衡:CH3COOH
科目:高中化学
来源:
题型:阅读理解
科目:高中化学
来源:
题型:阅读理解
科目:高中化学
来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版)
题型:选择题
在醋酸中存在电离平衡:CH3COOH A.加入盐酸 B.加入NaOH(s) C.加蒸馏水 D.升高温度
科目:高中化学
来源:2014届广东东莞第七高级中学高二上期中考试化学试卷(解析版)
题型:选择题
在醋酸中存在电离平衡:CH3COOH
A.加水 B.加热 C.加CH3COONa固体 D.加很稀的NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 CH3COO-+H+,要使溶液中的c(CH3COO-)提高,可以加入可以提供CH3COO-的盐,故选C,加热可以使平衡向吸热方向移动,故选B,加水会稀释使浓度降低;加很稀的NaOH溶液,同样相当于稀释;故选BC。
CH3COO-+H+,要使溶液中的c(CH3COO-)提高,可以加入可以提供CH3COO-的盐,故选C,加热可以使平衡向吸热方向移动,故选B,加水会稀释使浓度降低;加很稀的NaOH溶液,同样相当于稀释;故选BC。
考点:电离平衡的影响因素
点评:以下列表归纳了外界条件变化对电离平衡及c(H+)的影响,这里假设弱电解质AB可以电离成(A+)和(B-),且电离过程吸热,
则电离方程式 AB=(可逆反应)=(A+)+(B-) 条件改变内容 v(正),v(逆)关系 平衡移动方向 增大c(AB) v(正)>v(逆) 向右 减小c(AB) v(正)<v(逆) 向左 增大c(A+) v(正)<v(逆) 向左 减小c(A+) v(正)>v(逆) 向右 增大c(B—) v(正)<v(逆) 向左 减小c(B—) v(正)>v(逆) 向右 稀释溶液 v(正)>v(逆) 向右 升高温度 v(正)>v(逆)


填充图册中国地图出版社系列答案
第1考卷课时卷系列答案

书立方吉林专版系列答案
奇迹课堂系列答案
初中伴你学习新课程系列答案
同步训练与闯关系列答案
新支点卓越课堂系列答案
优干线测试卷系列答案
优干线课课练系列答案
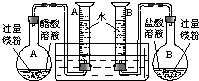 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
(2)改进装置后,检查一侧装置的气密性的方法是
(3)欲配制100mL实验所需浓度的盐酸,除50mL量筒、烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
正确操作,记录得到下表中部分实验数据.分析数据,观察实验装置图,回答下列问题:
(4)在实验数据中:①t(a1)远远大于t(b1)的原因为:
A烧瓶中
B烧瓶中
20℃、101kPa
50mL量筒内气体读数反应时间
A瓶
B瓶
40mL0.1mol/L
醋酸溶液40mL0.1mol/L
盐酸溶液5mL
t(a1)=155s
t(b1)=7s
10mL
t(a2)=310s
t(b2)=16s
15mL
t(a3)=465s
t(b3)=30s
20mL
t(a4)=565s
t(b4)=64s
…
…
…
44.8mL
t(an)=865s
t(bn)=464s
②由
(5)通过该实验可得到的结论是(回答出两点即可):①
(1)实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由).选择的金属是
(2)实验原理:(用离子方程式表示)
(3)甲同学设计的实验装置,乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进.你认为乙同学改进的措施是:
(4)按改进后的装置进行实验,实验中HCl与金属反应产生H2质量随时间变化的关系见图一,计算实验在80-120s范围内HCl的平均反应速率
(5)请在答题卡的框图中,画出HAc、H2SO4与金属反应产生H2质量随时间变化关系的预期结果示意图.
(6)量筒的规格由
(7)对盐酸和醋酸反应图象的异同,你的解释是 CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )
CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )  CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。
ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号