
| A. | 反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,是因为△H<0 | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
分析 A、该反应为熵减的反应,若能自发,则△H<0;
B、根据原电池原理,活泼的一极为负极,更容易被氧化;
C、根据盐类水解的知识,加酸、碱会抑制水的电离;
D、浓硫酸作催化剂,加稀硫酸使得氢离子浓度增大,平衡逆向移动.
解答 解:A、该反应为熵减的反应,若能自发,则△H<0,故A正确;
B、根据原电池原理,活泼的一极为负极,更容易被氧化,铝比铜活泼,故B错误;
C、根据盐类水解的知识,加酸、碱会抑制水的电离,NaHSO4中的氢离子完全电离,会抑制水的电离,故C错误;
D、浓硫酸作催化剂,加稀硫酸使得氢离子浓度增大,平衡逆向移动,故D错误.
故选:A.
点评 本题考查了反应是否能自发进行的依据、盐类的水解、弱电解质的电离平衡及平衡移动原理,难度不大,要求学生有扎实的基础.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:解答题
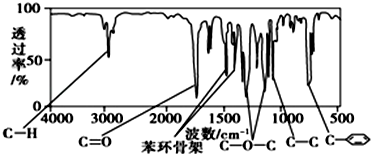
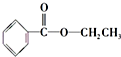 、
、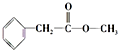 ;
;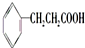 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
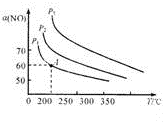 | 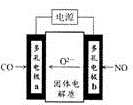 | 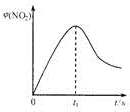 |
| 图1 | 图2 | 图3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
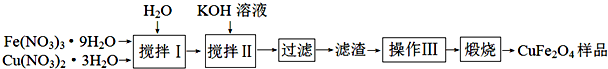

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32+H3O+?HCO3-+H2O3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
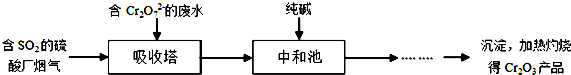
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com