
| A. | 白磷在260℃时转化为红磷 | B. | 石墨在高温下转化为金刚石 | ||
| C. | NaCl熔化 | D. | 氧化钙吸水 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的原子半径在五种原子中最大 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | X与Y形成的化合物只有一种 | |
| D. | R的最高价氧化物的水化物的酸性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
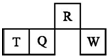 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物对应的水化物不能和强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 室温下其单质呈粉末状黄色固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3个 |
| D | 元素最高正价是+7价 |
| E | 主族元素中得电子能力最强 |
| F | 空气的主要成分之一,其某种同素异形体是保护地球地表环境的重要屏障 |
| G | 第3周期元素的简单离子中半径最小 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质铜与稀硝酸反应:Cu+2 H++2NO3-═Cu2++2 NO↑+H2O | |
| B. | NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 氨水吸收少量的二氧化硫:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3 | B. | c(H+)=5×10-5mol/L | ||
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=6 | D. | c(OH-)=10-12mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com