
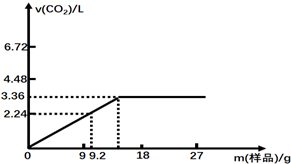
分析 (1)由图可知,发生H++HCO3-=H2O+CO2↑,n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol时盐酸完全反应,结合c=$\frac{n}{V}$计算;
(2)设NaHCO3与KHCO3的物质的量分别为x、y,由图中混合物质量9.2g及生成气体为2.24L列方程租计算.
解答 解:(1)NaHCO3和KHCO3与盐酸反应本质都是碳酸氢根离子与氢离子反应生成二氧化碳与水,反应的离子方程式为H++HCO3-=H2O+CO2↑,由图中数据可知,盐酸完全反应生成CO23.36L即0.15mol,由反应可知n(HCl)=0.15mol,盐酸的物质的量浓度为$\frac{0.15mol}{0.05L}$=3mol/L,
故答案为:3;
(2)由图可知9.2g样品完全反应生成$\frac{2.24L}{22.4L/mol}$=0.1molCO2,设9.2g混合物中NaHCO3、KHCO3的物质的量分别为x mol、y mol,
则有:$\left\{\begin{array}{l}{x+y=0.1}\\{84x+100y=9.2}\end{array}\right.$,解得:x=y=0.05,则混合物中NaHCO3、KHCO3的物质的量之比为1:1,
故答案为:1:1.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意图象数据的分析与应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③⑤ | C. | ①②③ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO42-、Ba2+ | B. | Na+、Ca2+、Cl- | C. | H+、OH-、NO3- | D. | H+、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与锌粒反应生成气体 | B. | 浓硫酸使铁、铝钝化 | ||
| C. | 浓硫酸与铜反应加热反应产生SO2 | D. | 浓硫酸和木炭在加热条件下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂不会改变该反应的逆反应速率 | |
| B. | 增大SO2(g)的浓度,逆反应速率会减小 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
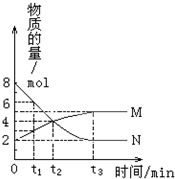 在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,保持恒温恒容,再充入N,N的转化率保持不变 | |
| D. | t3时,其他条件不变,改变温度,平衡一定发生移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com