
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
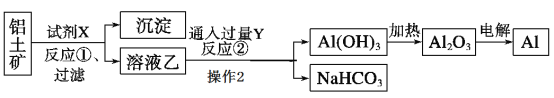
(1)试剂X应选择________(选填“氢氧化钠溶液”、“盐酸”),反应①过滤后所得沉淀为__ ;反应①的离子方程式_____;
(2)反应②中Y是_____(写化学式);
(3)写出由Al(OH)3加热为Al2O3的反应方程式_______
【答案】氢氧化钠溶液 Fe2O3 Al2O3+2OH- =2AlO2-+H2O CO2 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
由于Al2O3属于两性氧化物,而Fe2O3属于碱性氧化物,所以应选用氢氧化钠溶液溶解Al2O3;由溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳;过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,据此可解题。
(1)由上述分析可以知道,试剂X应选择氢氧化钠溶液,氧化铁与氢氧化钠不反应,反应①后过滤所得沉淀为氧化铁;反应①为Al2O3和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH- =2AlO2-+H2O;
因此,本题正确答案是:氢氧化钠溶液 ;Fe2O3 ;Al2O3+2OH- =2AlO2-+H2O;
(2)反应②为偏铝酸钠溶液和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,则Y是CO2;
因此,本题正确答案是:CO2;
(3)Al(OH)3加热生成Al2O3和水,反应方程式为:2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。


科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是
A. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
B. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
D. 0.1mol ·L-1Na2CO3溶液与同浓度等体积盐酸混合的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程如下图所示:
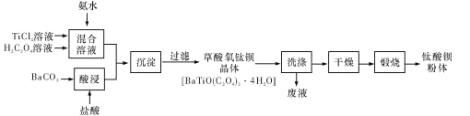
(1)镁的碳化物常见的有MgC2和Mg2C3两种,它们均极易与水发生反应。写出MgC2发生水解反应的化学方程式:_____;Mg2C3的电子式为_____。
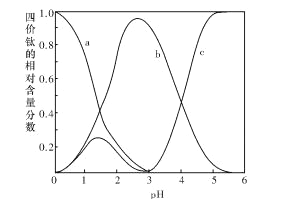
(2)“混合溶液”环节,钛元素在不同pH下主要以种形式存在,如上图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为______填化学符号);写出“沉淀”时的离子方程式:_____。
(3)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案为_____。
(4)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通入Cl2)并加热到900℃制取TiCl4。请写出该法制备TiCl4的化学方程式:_____。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2C03溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于_____mol/L才能开始转化。(已知常温下:![]()
![]() ,略CO32-的水解)。
,略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;
乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
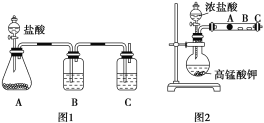
((1)甲同学设计实验的依据是强酸制弱酸,请回答下列问题
A中锥形瓶装入的是碳酸钙固体,A中发生的离子方程式为:_____,
B应放入的物质是____,其作用为____;
C中是Na2SiO3溶液该反应的离子方程式为___________。
(2)乙同学的实验原理是强氧化剂生成弱氧化剂。
如果A处的棉花由白色变成棕色,则A处的离子方程式为___,B处的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验制备2-羟基-4-苯基丁酸乙酯,反应原理、装置和数据如下:


相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
乙醇 | 46 | 0.789 | 78.4 | 易溶 |
2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
实验步骤:
①如图1,在干燥的圆底烧瓶中加入20mL2-羟基-4-苯基丁酸、20mL无水乙醇和适量浓硫酸,再加入几粒沸石;
②加热至70℃左右保持恒温半小时;
③分离、提纯三颈瓶中的粗产品,得到有机粗产品;
④精制产品。
请回答下列问题:
(1)油水分离器的作用为____________________。实验过程中发现忘记加沸石该如何操作_______________________。
(2)本实验采用____________加热方式(填“水浴”、“油浴”或“酒精灯加热”)。
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液和水洗涤。第二次水洗的目的是___________________。
(4)在精制产品时,加入无水MgSO4的作用为___________________;然后过滤,再利用如图2装置进行蒸馏纯化,图2装置中的错误有__________________________。
(5)若按纠正后的操作进行蒸馏纯化,并收集212℃的馏分,得2-羟基-4-苯基丁酸乙酯约9.0g。则该实验的产率为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
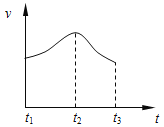
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是________,t2~t3速率变化的主要原因是_____________。
(2)实验②放出氢气的量减少的原因是_____________。(用离子方程式表示)
(3)实验③反应速率加快的主要原因是___________。
II、一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
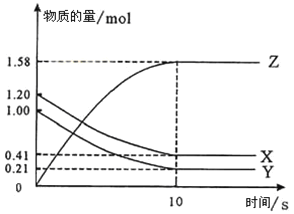
(1)写出该反应的化学方程式_______________。
(2)反应开始到10s,用X表示的反应速率是__________。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
a. 当X与Y的反应速率之比为1:1
b. 混合气体中X的质量分数保持不变
c. X、Y、Z的浓度之比为1:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com