
����Ŀ��ijУ�о���ѧϰС���ͬѧѧϰ�굪���й�����֮�Ե�Ԫ�ص��⻯�������������ʽ����˸�������о���
��.NH3������̽��
(1)ʵ������ȡ�����Ļ�ѧ����ʽΪ_______________________��
(2)ijͬѧģ���ű���ʳ��ˮ�ռ������ķ����������ű����Ȼ����Һ�ķ����ռ�����������Ϊ���ܷ�ﵽĿ�ģ�________(��ܡ���)��������_____________________________��
(3)��С���ͬѧ���������ͼ��ʾ��ʵ��װ��(�гּ�β������װ��δ����)��̽�������Ļ�ԭ�ԡ�

�ٸ�װ�����������һ��ȱ�ݣ�Ϊ��֤ʵ������ȷ�ԣ��Ը�װ�õĸĽ���ʩ��______________________��
�����øĽ����װ�ý���ʵ�飬�۲쵽CuO��Ϊ��ɫ���ʣ���ˮCuSO4����ɫ��ͬʱ����һ������Ⱦ�����塣������CuO��Ӧ�Ļ�ѧ����ʽΪ_______________________________��
����ͬѧ��Ϊ��NH3��CuO��Ӧ���ɵĺ�ɫ�����п��ܺ���Cu2O����֪��Cu2O��һ�ּ����������������Һ�У�Cu����Cu��Cu2���������һ����ʵ�����ú�ɫ�������Ƿ���Cu2O��_____________________________��
��.NO2������̽��
��С���ͬѧ���������ͼ��ʾװ�ã�������ȡNO2����֤NO2�ܷ�֧��ľ��ȼ��(����N2O4�Ĵ��ڣ�ͼ������̨�ȼг�����������ȥ)����֪��2Cu(NO3)2![]() 2CuO��4NO2����O2����
2CuO��4NO2����O2����

(4)������ƿ�г�������ɫ����ʱ��ľ����ȼ�ˡ��е�ͬѧ�ó���NO2��֧��ľ����ȼ�ա��Ľ��ۡ�����Ϊ��һ�����Ƿ���ȷ��________(���ȷ������ȷ��)��������___________________________��
(5)NH3��NO2��һ�������¿��Է�Ӧ��������Ⱦ�����壬������NH3�Ļ�ԭ�ԣ���ѧ����ʽΪ___________________________��
���𰸡�(1)2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O
CaCl2��2NH3����2H2O
(2)�� ������������ˮ���Ȼ�臨�����ˮ�е��ܽ��Ӱ�첻�� (3)����װ��A��B֮������װ�м�ʯ�ҵĸ���� ��3CuO��2NH3![]() 3Cu��3H2O��N2 ��ȡ������Ʒ������ϡH2SO4������Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�� (4)��ȷ ����ͭ�ֽ�����Ļ����������������������������������������൱�������д����ǵ�ľ������ȼ������NO2��O2���������ľ����ȼ������NO2��֧��ȼ��
3Cu��3H2O��N2 ��ȡ������Ʒ������ϡH2SO4������Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�� (4)��ȷ ����ͭ�ֽ�����Ļ����������������������������������������൱�������д����ǵ�ľ������ȼ������NO2��O2���������ľ����ȼ������NO2��֧��ȼ��
(5)8NH3��6NO2![]() 7N2��12H2O
7N2��12H2O
��������(1)ʵ������ȡ����ʹ�ù�����ʯ�Һ�NH4Cl���ʻ�ѧ����ʽΪ2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O��(2)������ˮ�е��ܽ����1��2���ڱ���ʳ��ˮ�е��ܽ�ȸ�С��������������ˮ���Ȼ�臨�����ˮ�е��ܽ��Ӱ�첻�ʲ������ű����Ȼ����Һ�ķ����ռ�������(3)��Aװ���л���ˮ�������ɣ���Ӧ����װ��A��B֮������װ�м�ʯ�ҵĸ���ܳ�ȥˮ������������ź���ʵ����ˮ�����ļ��顣����ˮCuSO4����ɫ��˵����Ӧ��ˮ�������ɣ�CuO��Ϊ��ɫ���ʣ�Ӧ����Cu������������ԭ��Ӧ����������Ӧ����N2����������CuO��Ӧ�Ļ�ѧ����ʽΪ3CuO��2NH3
CaCl2��2NH3����2H2O��(2)������ˮ�е��ܽ����1��2���ڱ���ʳ��ˮ�е��ܽ�ȸ�С��������������ˮ���Ȼ�臨�����ˮ�е��ܽ��Ӱ�첻�ʲ������ű����Ȼ����Һ�ķ����ռ�������(3)��Aװ���л���ˮ�������ɣ���Ӧ����װ��A��B֮������װ�м�ʯ�ҵĸ���ܳ�ȥˮ������������ź���ʵ����ˮ�����ļ��顣����ˮCuSO4����ɫ��˵����Ӧ��ˮ�������ɣ�CuO��Ϊ��ɫ���ʣ�Ӧ����Cu������������ԭ��Ӧ����������Ӧ����N2����������CuO��Ӧ�Ļ�ѧ����ʽΪ3CuO��2NH3![]() 3Cu��N2��3H2O���ۼ���Cu���Ƿ���Cu2O������Cu����ϡ���ᷴӦ����Cu2O�����Ի���������Cu2��ʹ��Һ����ɫ���ʿ���ȡ������Ʒ������ϡH2SO4������Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�С�(4)�ڼ���ƿ���ռ�������NO2��O2�������Ϊ4��1����ʱ�����������������������������������������൱�������д����ǵ�ľ������ȼ������NO2��O2���������ľ����ȼ��˵��NO2��֧��ȼ�ա�(5)NH3��NO2��һ�������¿��Է�Ӧ��������Ⱦ�����壬������NH3�Ļ�ԭ�ԣ������ɵ������ǵ�������Ӧ����ʽ��8NH3��6NO2
3Cu��N2��3H2O���ۼ���Cu���Ƿ���Cu2O������Cu����ϡ���ᷴӦ����Cu2O�����Ի���������Cu2��ʹ��Һ����ɫ���ʿ���ȡ������Ʒ������ϡH2SO4������Һ������ɫ��˵����ɫ�����к���Cu2O����֮��û�С�(4)�ڼ���ƿ���ռ�������NO2��O2�������Ϊ4��1����ʱ�����������������������������������������൱�������д����ǵ�ľ������ȼ������NO2��O2���������ľ����ȼ��˵��NO2��֧��ȼ�ա�(5)NH3��NO2��һ�������¿��Է�Ӧ��������Ⱦ�����壬������NH3�Ļ�ԭ�ԣ������ɵ������ǵ�������Ӧ����ʽ��8NH3��6NO2![]() 7N2��12H2O��
7N2��12H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӧ��ͼ�����ж��������˵����ȷ����
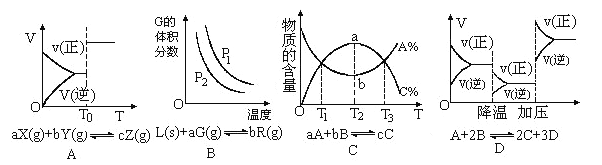
A���ܱ������з�Ӧ�ﵽƽ�⣬t0ʱ�ı�ijһ��������ͼ�仯��ʾ����ı������ֻ���Ǽ������
B����Ӧ�ﵽƽ��ʱ���������ƽ��Ӱ���ϵ��ͼ��ʾ��������ӦΪ���ȷ�Ӧ����a��b
C�����ʵ������¶ȹ�ϵ��ͼ��ʾ����÷�Ӧ������ӦΪ���ȷ�Ӧ
D����Ӧ���ʺͷ�Ӧ�����仯��ϵ��ͼ��ʾ����÷�Ӧ������ӦΪ���ȷ�Ӧ����A��B��C��D��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϡ�����ϡ����Ļ����Һ�У�����ͭ�ۡ�
��1������100mL 2mol/L HNO3��100mL 1mol/L H2SO4��Ϻ���19.2g ͭ�ۣ��ȣ���ַ�Ӧ��
����������Һ����仯����Һ��ͭ�������ʵ���Ũ��Ϊ mol/L
�����������ۺϳɱ�״������� L��
����ʹͭ��ȫ���ܽ⣬�������1mol/L H2SO4 mL
��2����c(SO![]() )��c(NO
)��c(NO![]() )��5.0 mol��L��1��ȡ200 mL�û���ᣬ�����ܽ�ͭ���������Ϊ g
)��5.0 mol��L��1��ȡ200 mL�û���ᣬ�����ܽ�ͭ���������Ϊ g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ������Һ��˵������ȷ������ ��
A.���岻��һ�����ȶ�,���ú��ײ�������;��Һ��һ���ȶ�,���ú�������
B.�����˶��ǽ����������е��˶���ʽ,���Ծݴ˽���������Һ������Һ���ֿ���
C.����ͨ��ʱ,���巢�������ЧӦ,��Һ���ܷ��������ЧӦ
D.ֻ�н�״���罺ˮ������������ʲ��ܳ�Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������2H++CO32���TCO2��+H2O��ʾ�ķ�Ӧ�ǣ� ��
A.������Һ��̼������Һ��Ӧ
B.ϡ������̼������Һ��Ӧ
C.ϡ������̼�����Һ��Ӧ
D.����������Һ��̼�����Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��s��+3Y��g��![]() Z��g�� ��H=��a kJ��mol��1 ��һ�������£���2mol X��2 mol Yͨ��2L�ĺ����ܱ������У���Ӧ10s���������0.5molZ������˵����ȷ����
Z��g�� ��H=��a kJ��mol��1 ��һ�������£���2mol X��2 mol Yͨ��2L�ĺ����ܱ������У���Ӧ10s���������0.5molZ������˵����ȷ����
A��10s�ڣ�X��ƽ����Ӧ����Ϊ0.025 mol��L��1��s��1
B����10sʱ��Y�ķ�Ӧ����Ϊ0.075 mol��L��1��s��1
C����10sʱ��XΪ 1.5 mol��Y��Ũ��Ϊ0.25 mol��L��1
D��10s�ڣ�X��Y��Ӧ�ų�������Ϊa kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��������߳��ĵ����þƬ������̿Ϊ�缫�����ϵμ�ʳ��ˮ���ر�ɹ�������ط�ӦΪ2Mg+O2+2H2O = 2Mg ��OH��2 ���й��ڸõ�ص�˵���������

A��Mg�缫�ĵ缫��Ӧʽ��Mg-2e-��Mg2+
B�����ֵ�صĹ���ԭ��������Ϊ��þ��������ʴ
C������̿�缫�Ϸ���������Ӧ
D����ع���ʱʵ���˻�ѧ������ܵ�ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
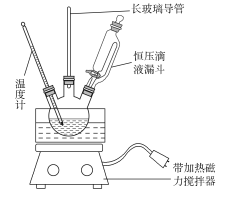
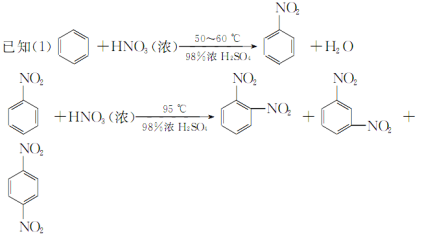
����Ŀ������������Ҫ�ľ�ϸ����ԭ�ϣ���ҽҩ��Ⱦ�ϵ��м��壬�������л��ܼ����Ʊ��������Ĺ������£�
����װ����ͼ��Ӧװ�á����ƻ��ᣬȡ100 mL�ձ�����20 mL Ũ������18 mLŨ�������ƻ��ᣬ����©���У���18 mL ������������ƿ�С�
���������µı�����μ�����ᣬ�ߵα߽��裬��Ͼ��ȡ�
����50��60 ���·�����Ӧ��ֱ����Ӧ������
�ܳ�ȥ����ֲ�Ʒ����������ˮ��10% Na2CO3��Һϴ�ӣ������������ˮϴ�ӵõ��ֲ�Ʒ��
(2)�����õ����й������б����£�
�� �� | �۵�/�� | �е�/�� | �ܶ�(20 ��) /(g��cm��3) | �ܽ��� |
�� | 5.5 | 80 | 0.88 | ����ˮ |
������ | 5.7 | 210.9 | 1.205 | ������ˮ |
1��3���������� | 89 | 301 | 1.57 | ����ˮ |
Ũ���� | �� | 83 | 1.4 | ������ˮ |
Ũ���� | �� | 338 | 1.84 | ������ˮ |
��ش��������⣺
(1)���ƻ���Ӧ���ձ����ȼ���________��
(2)��ѹ��Һ©�����ŵ���__________________________________��
(3)ʵ��װ���г��������ܿ���________����(����������)��
(4)��Ӧ�������Ʒ��Һ���________��(��ϡ����¡�)���������Ͳ�Ʒ�IJ�������Ϊ________________________________��
(5)��10%Na2CO3��Һϴ��֮����������ˮϴ��ʱ��������֤Һ����ϴ���� __________________________��
(6)Ϊ�˵õ�������������������������Һ���м���____________��ȥˮ��Ȼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������������װ��ģ�ҵ���������Ʊ���ˮ�Ȼ�����183��ʱ����������ʪ����������������������
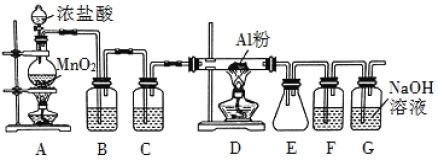
��ش��������⣺
��1��װ�� B ��ʢ�ű���ʳ��ˮ���������� ��F ��ʢ�ŵ��� ���������� ����һ������װ���ʵ��Լ���Ҳ���� F �� G �����ã���װ����Լ�Ϊ ��
��2��װ�� A ʵ�鿪ʼʱ���ȼ��װ�������ԣ��������IJ��������� ������ţ���
A������ƿ�м��� MnO2 ��ĩ B������ C������ƿ�м���Ũ����
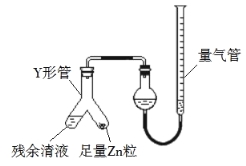
��3���Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ ����ܶ�ʵ�鷽�������з���֮һΪ�ò�����Һ�������� Zn ��Ӧ���������ɵ� H2����� װ����ͼ��ʾ���г���������ȥ������Ӧ��ϣ�ÿ��� 1 ���Ӷ�ȡ������������������С��ֱ�����䡣���������μ�С��ԭ���� ���ų�������ʵ�������Ӱ�����أ���
��4����С��ͬѧ�����ϵ�֪��������ع����Ũ������Ҳ������������ͬʱ�д��� ClO2 ���ɣ�ClO2 �е�Ϊ 10 �����۵�Ϊ59 ����Һ��Ϊ��ɫ��Cl2 �е�Ϊ34 ����Һ̬Ϊ����ɫ��������ʵ����֤ Cl2�к��� ClO2�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com