
甲、乙两种金属:①甲比乙容易与H2O反应;②甲单质能与乙的阳离子发生置换反应;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某非金属反应时,甲原子失去的电子数目比乙多;⑤甲与乙作为电极材料,盐酸做电解质溶液构成原电池,甲为正极。能说明甲比乙的金属性强的是( )
A.①③④ B.①③④⑤
C.①②③ D.①②③④
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:选择题
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

A.1:1 B.2:3 C.3:2 D.2:1
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高中高三第四次模拟理综化学试卷(解析版) 题型:选择题
下列关于有机化合物的结构、性质的叙述正确的是
A.糖类、油脂、蛋白质的水解产物都是非电解质
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“-OH”
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:填空题
人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl
①该电池的负极反应式是______________;
②在电池中,Na+不断移动到“水”电池的_______极(填“正”或“负”);
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是______________。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如右图所示。
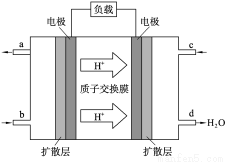
①该电池工作时,b口通入的物质为______________。
②该电池负极的电极反应式______________。
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第二周期元素的最高化合价为+1→+7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
用锌块与30mL3mol/L盐酸反应制取H2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸③改用粉末状锌
④适当升高温度⑤加入几滴CuSO4溶液
A.①②④ B.②③④
C.①③④⑤ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:填空题
I.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等。请回答:
(1)BaO2的电子式为__________。
(2)BaO2在有水存在下,通过与二氧化碳作用,分解生成过氧化氢,其化学反应方程式为__________。
(3)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示其原理__________。
(4)配平下列反应方程式:
( )MnO4- + ( )BaO2 + __________= ( )Ba2++( )Mn2+ + __________+( )H2O
Ⅱ、2.38g化合物甲,在空气中充分煅烧后,得固体残留物乙1.82g和标准状况下896mL气体A,该气体能使品红溶液褪色,加热后品红溶液恢复至原色。所得固体残留物乙能全部溶于稀硫酸得溶液B,能部分溶于NaOH溶液中得溶液C和0.8g残留物D。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。
请推测并回答:
(1)用离子反应方程式解释溶液变为血红色的原因:__________。
(2)写出形成溶液C的化学方程式:__________。
(3)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:__________。
(4)写出化合物甲的化学式__________。
(5)有人认为:化合物甲中部分元素所形成的合金,在气体A中可逐渐形成化合物甲,试从氧化还原的角度,分析该说法的合理性:__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH—(aq)═H2O(l)△H=-57.3kJ/mol
B.向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:
3NH4++Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
C.淀粉碘化钾溶液在空气中变蓝:4I—+O2+4H+═2I2+2H2O
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32—+6H++2MnO4—═5SO42—+2Mn2++3H2O
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
下列颜色变化与氧化还原反应无关的是
A.将乙醛加入新制氢氧化铜中加热,出现砖红色沉淀
B.将乙醇滴入酸性重铬酸钾溶液中,溶液由橙色变为绿色
C.将二氧化硫通入滴有酚酞的氢氧化钠溶液中,溶液红色褪去
D.新制氯水敞口久置,颜色褪去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com