
分析 2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O反应中NaClO3中氯元素化合价+5价变化为+4价为氧化剂,4HCl参加反应有2HCl中氯元素化合价-1价变化为0价为还原剂,电子转移2e-,据此分析解答;
解答 解:(1)反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价,NaClO3中氯氯元素化合价+5价变化为+4价做氧化剂,电子转移2e-,
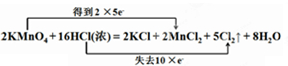
用双线桥法标出电子转移的方向和数目为: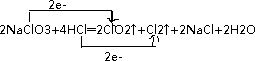
答:用双线桥法标出电子转移的方向和数目为: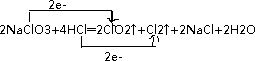 ;
;
(2)2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O反应中NaClO3中氯元素化合价+5价变化为+4价为氧化剂,4HCl参加反应有2HCl中氯元素化合价-1价变化为0价为还原剂,所以氧化剂和还原剂的物质的量之比为2:2=1:1,故答案为:1:1;
(3)根据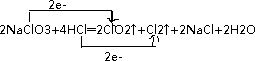 ,则反应中转移的电子的物质的量为1mol,则标准状况下生成的气体的体积是0.5mol×22.4L/mol=11.2L,故答案为:11.2L.
,则反应中转移的电子的物质的量为1mol,则标准状况下生成的气体的体积是0.5mol×22.4L/mol=11.2L,故答案为:11.2L.
点评 本题考查ClO2的制备反应,侧重氧化还原反应的考查,题目难度不大,注意氧化还原反应基本原理的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜基态原子核外电子排布式为1s22s22p63s23p64s13d10 | |
| B. | 在d轨道中电子排布成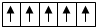 而不是 而不是 ,其最直接的根据是泡利原理 ,其最直接的根据是泡利原理 | |
| C. | 下列轨道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反应、激光、霓虹灯光等与原子核外电子发生跃迁释放能量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.288g | B. | 0.366g | C. | 0.384g | D. | 0.396g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
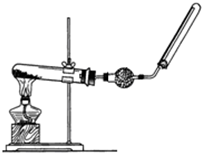 实验室中若用如图所示的装置制取并收集干燥的氨气.
实验室中若用如图所示的装置制取并收集干燥的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
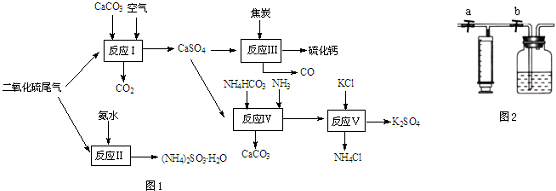
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com