
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①② |
分析 ①ⅤA族中,N的非金属性最强,氨气中分子之间存在氢键;
②乙醇、乙酸与水分子之间能形成氢键;
③冰中存在氢键,其体积变大;
④标准状况下,HF为液态,是因为HF分子之间存在氢键;
⑤氧的非金属性强于硫,所以H2O比H2S稳定;
解答 解:①因①ⅤA族中,N的非金属性最强,氨气中分子之间存在氢键,则氨气的熔、沸点比ⅤA族其他元素氢化物的高,故①正确;
②因乙醇、乙酸与水分子之间能形成氢键,则乙醇、乙酸可以和水以任意比互溶,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④标准状况下,HF为液态,是因为HF分子之间存在氢键,故④正确;
⑤氧的非金属性强于硫,所以H2O比H2S稳定,与氢键无关,故⑤错误;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 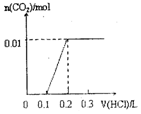 | B. | 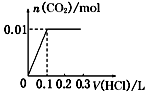 | C. | 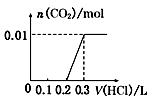 | D. | 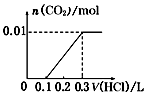 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
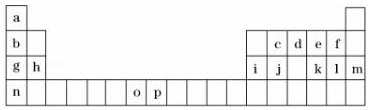
| 元素 | O | P | |
| 电离能/KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任意位置寻找 | B. | 稀有气体元素中寻找 | ||
| C. | 金属和非金属的分界线处寻找 | D. | 活泼金属和活泼非金属区中寻找 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能够在空气中剧烈燃烧 | |
| B. | 都能够与水反应生成碱和H2 | |
| C. | 都可以保存在煤油中 | |
| D. | 都是密度比较小、熔点比较低的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
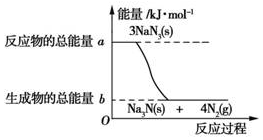 减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.
减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
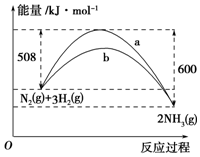 如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂.
如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用品红溶液鉴别SO2和CO2两种气体 | |
| B. | 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| C. | 加热可除去Na2CO3固体中少量的NaHCO3 | |
| D. | 向某溶液中先加少量氯水,再滴加KSCN溶液后变红,则原溶液中一定含有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com