
【题目】依据下列信息,完成填空:
(1)某单质位于短周期,是一种常见的半导体材料。在25℃、101kPa下,其气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是___。
(2)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1,2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,则反应: Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为___。
(3)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H22HF | 1.8×1036 | 1.9×1032 |
Cl2+H22HCl | 9.7×1012 | 4.2×1011 |
Br2+H22HBr | 5.6×107 | 9.3×106 |
I2+H22HI | 43 | 34 |
①已知t2>t1,生成HX的反应是___反应(填“吸热”或“放热”)。
②K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时热量变化值为Q1;反之,2molHI分解达平衡时热量变化值为Q2,则:Q1___Q2(填“>”“<”“=”)。
【答案】SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1520.0kJ·mol-1 -259.7kJ·mol-1 放热 同一主族元素从上到下原子核外电子层数依次增多 >
【解析】
(1)某单质位于短周期,是一种常见的半导体材料,该元素为硅,根据题意发生反应为SiH4+2O2═SiO2+2H2O,根据反应,1mol SiH4参与反应时转移8mole,据此计算书写热化学方程式;
(2)根据盖斯定律计算;
(3)①温度升高,平衡常数减小,说明平衡向逆反应方向移动,HX的生成反应为放热反应;
②平衡常数越大,说明反应越易进行,F、Cl、Br、I的得电子能力依次减小的主要原因是:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力依次减弱;
③由于HX的生成反应为放热反应,则HX的分解反应为吸热反应。
(1)某单质位于短周期,是一种常见的半导体材料,该元素为硅,根据题意发生反应为SiH4+2O2═SiO2+2H2O,根据反应,1mol SiH4参与反应时转移8mole,所以,当有1molSiH4参加反应时,放出热量为190.0kJ×8=1520.0kJ,其热反应方程式为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=1520.0kJmol1;
(2)已知:①2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1
②2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,
根据盖斯定律,![]() ×(①-②)可得:Zn(s)+HgO(s)=ZnO(s)+Hg(l)ΔH=-259.7kJ·mol-1;
×(①-②)可得:Zn(s)+HgO(s)=ZnO(s)+Hg(l)ΔH=-259.7kJ·mol-1;
(3)①由表中数据可知,温度越高平衡常数越小,这说明升高温度平衡向逆反应方向移动,所以HX的生成反应是放热反应;
②平衡常数越大,说明反应越易进行,F、Cl、Br、I的得电子能力依次减小的主要原因是:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力依次减弱造成的;
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时,设I2的转化浓度为x,列三段式:
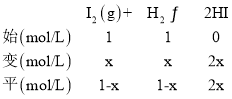
K=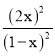 =43,解得x=
=43,解得x=![]() ,则I2的转化率=
,则I2的转化率=![]() ×100%≈76.7%,即1molI2(g)和1molH2反应达平衡时的转化率为76.7%,由于在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应与2molHI分解反应互为等效平衡,两个反应的转化率之和等于1,则2molHI分解达平衡时HI的转化率=1-76.7%=23.3%,转化的量越多,平衡时热量变化值越大,则Q1>Q2。
×100%≈76.7%,即1molI2(g)和1molH2反应达平衡时的转化率为76.7%,由于在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应与2molHI分解反应互为等效平衡,两个反应的转化率之和等于1,则2molHI分解达平衡时HI的转化率=1-76.7%=23.3%,转化的量越多,平衡时热量变化值越大,则Q1>Q2。


科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置进行液体石蜡分解及其产物性质实验。下列操作或叙述错误的是

A.装置b、c中发生反应的基本类型不同
B.实验中可能看不到b、c中溶液明显褪色
C.d中溶液变浑浊证明石蜡分解产生了CO2
D.停止加热后立即关闭K可以防止液体倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
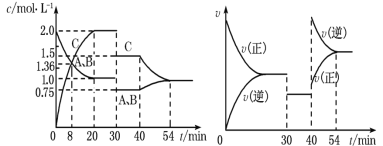
下列说法中正确的是( )
A.30min~40min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30min时降低温度,40min时升高温度
D.8min前A的平均反应速率为0.08mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学研究、工农业生产、环境保护、日常生活等方面有广泛联系。下列有关说法中正确的是
A.石灰石可用于炼铁、制水泥、制玻璃
B.使用苯代替酒精擦拭手机屏幕
C.同位素示踪法、红外光谱法都是科学家经常使用的研究化学反应历程的手段之一
D.针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学的核心
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、科研密切相关,下列有关说法不正确的是
A.维生素C能帮助人体将![]() 转化为易吸收的
转化为易吸收的![]() ,维生素C具有氧化性
,维生素C具有氧化性
B.“火树银花合,星桥铁索开”,其中的“火树银花”涉及到焰色反应
C.中国蓝是人工合成的蓝色化合物,其化学式为![]() ,可改写成
,可改写成![]()
D.赏心悦目的雕花玻璃是使用氢氟酸对玻璃刻蚀而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学的应用十分广泛,是现代生产、生活、国防,乃至整个人类生活不可缺的物质条件。请根据所给材料回答下列问题:
(1)请结合组成原电池的条件,将氧化还原反应:2Fe3++Cu=2Fe2++Cu2+设计成一个原电池。
①电解液:___,
②正极材料:___;
③负极反应式:___。
(2)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)+MH![]() Ni(OH)2+M
Ni(OH)2+M
①电池放电时,负极的电极反应式为___。
②当该电池充电时,与外电源正极连接的电极上发生的反应是___。
A.H2O的还原 B.NiO(OH)的还原 C.H2的氧化 D.Ni(OH)2的氧化
(3)按如图电解饱和食盐水溶液,写出该电解池中发生反应的总反应式:___;将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各实验操作中错误的是![]()
![]() 实验室制乙烯时,温度计水银球应插入混合液中
实验室制乙烯时,温度计水银球应插入混合液中
![]() 配制氢氧化铜悬浊液时,向硫酸铜溶液中逐滴滴加氢氧化钠溶液,直到沉淀完全为止
配制氢氧化铜悬浊液时,向硫酸铜溶液中逐滴滴加氢氧化钠溶液,直到沉淀完全为止
![]() 配制银氨溶液时,向硝酸银溶液中逐滴滴加氨水,边滴边振荡,直到生成的沉淀溶解为止
配制银氨溶液时,向硝酸银溶液中逐滴滴加氨水,边滴边振荡,直到生成的沉淀溶解为止
![]() 用醋酸、碳酸氢钠、苯酚钠和必须的仪器可以检验苯酚、醋酸、碳酸的酸性强弱
用醋酸、碳酸氢钠、苯酚钠和必须的仪器可以检验苯酚、醋酸、碳酸的酸性强弱
![]() 做过银镜反应的试管用浓硝酸清洗
做过银镜反应的试管用浓硝酸清洗
![]() 卤代烃与氢氧化钠溶液共热后,再滴入硝酸银溶液,可检验卤原子的种类
卤代烃与氢氧化钠溶液共热后,再滴入硝酸银溶液,可检验卤原子的种类
![]() 若苯酚不慎沾到皮肤上,应立即用酒精洗涤
若苯酚不慎沾到皮肤上,应立即用酒精洗涤
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关说法正确的是 ( )
A.用pH均为3的醋酸和盐酸中和等物质的量NaOH溶液,醋酸消耗的体积多
B.pH均为11的CH3COONa溶液和氨水中,CH3COONa溶液中水的电离程度大
C.0.10 mol·L-1CH3COONa的pH小于0.10 mol·L-1 NaCN溶液的pH,则酸性:CH3COOH<HCN
D.0.10 mol·L-1醋酸溶液的pH=a,稀释n倍后pH=a+1,则n<10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式:
(1) 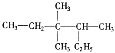 的名称(系统命名法)__________________。
的名称(系统命名法)__________________。
(2)2,2﹣二甲基﹣3﹣乙基己烷 的结构简式________________________________
(3)2﹣甲基﹣2﹣丁烯 的结构简式_________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com