
| A. | CH3-CH=CH2和  | |
| B. |  和 和  | |
| C. |  和 和 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 是一种新型化合物 | B. | 与金刚石互称同分异构体 | ||
| C. | 相对分子质量为720 g/mol | D. | 摩尔质量为720 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol SO2和5 mol O2充分反应可生成2 mol SO3 | |
| B. | 2 mol SO2和1mol O2达到化学平衡时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| C. | 达到化学平衡时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 三种物质的浓度相等时,说明反应达到了化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=0的溶液中:Fe2+、Mg2+、SO42-、Cl- | |
| B. | 由水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、K+、Na+、NO3一 | |
| C. | 在A1C13溶液中:SO32-、Na+、CO32-、AlO2- | |
| D. | 在滴加石蕊试液后呈红色的溶液中:I一、Na+、S2-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
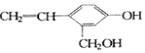 ,它不可能具有的性质是( )
,它不可能具有的性质是( )| A. | ⑤ | B. | ①②③④⑥⑦⑧ | C. | ①⑤⑦ | D. | ⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的水与重水含有的中子数相等 | |
| B. | 2.0g H${\;}_{2}^{18}$O与D2O的混合物中所含中子数为 NA | |
| C. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$ ${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,${\;}_{0}^{1}$n增加了10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间(Min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com