
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: _______________________________________________;
银片上发生的电极反应: _______________________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电量为1.60×10-19C)
科目:高中化学 来源: 题型:
有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一定时间,测得电极增重总和为2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1 C.4∶3 D.3∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应式为Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法不正确的是( )
A.该电池中Zn为负极,MnO2为正极
B.该电池的正极反应式为MnO2+e-+H2O—→MnOOH+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-都能通过薄层纸片
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨作电极电解下列溶液①稀H2SO4②K2SO4溶液 ③CuCl2溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2∶1的是(填序号)____________
______,其阳极的电极反应式都是____________________________________________,
阴极的电极反应式都是_______________________________________________,
总反应的化学方程式都是_____________________________________________。
(2)阴极、阳极都有气体产生,其中溶液pH变小的是____,pH变大的是______。(填序号)
(3)一个电极析出金属,一个电极逸出气体,且溶液pH明显减小的是____________(填序号),其总反应的化学方程式是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用Pt作电极,电解100 mL 0.4 mol·L-1的NaCl溶液和100 mL 0.1 mol·L-1的稀硫酸,标准状况下产生0.224 L Cl2时停止电解,取出电极,将两烧杯溶液混合并冷却至常温,所得溶液的pH为(设气体产物全部逸出,混合溶液的总体积为200 mL)( )
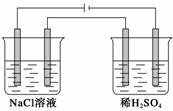
A.5 B.6 C.7 D.13
查看答案和解析>>
科目:高中化学 来源: 题型:
冶炼铜矿石所获得的铜通常含有锌、铁、镍、银、金和铂等微量杂质,俗称粗铜。工业上通常通过电解法除去这些杂质制得精铜,以提高铜的使用价值,扩大铜的应用范围。(几种金属的相对原子质量是:Fe-56,Ni-59,Cu-64,Zn-65,Ag-108,Au-197。)
请完成下列问题:
(1)一般来说,电解精炼铜的初始电解质溶液里的阳离子是__________,写出铜的电解精炼过程中的阴极反应式________________________________。
(2)如果转移0.020 mol e-,下列说法中一定正确的是________。
①阴极质量增加0.64 g ②阳极质量减少0.64 g
③电解质溶液的质量保持不变 ④电解质溶液的温度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
橡胶属于重要的工业原料。它是一种有机高分子化合物,具有良好的弹性,但强度较差。为了增强某些橡胶制品的强度,加工时往往需硫化处理,即将橡胶原料与硫黄在一定条件下反应。橡胶制品硫化程度越高,强度越大,弹性越差。下列橡胶制品中,加工时硫化程度较高的是 ( ) 。
。
A.橡皮筋 B.汽车外胎
C.普通气球 D.医用乳胶手套
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气(含有烃类、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂钯合金作催化剂)。它的特点是使CO和NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)下列说法错误的是 。
A.CO和NOx反应的化学方程式为2xCO+2NOx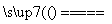 2xCO2+N2
2xCO2+N2
B.上述方法的缺点是由于CO2增多,会大大提高空气的酸度
C.多植树造林,增大绿化面积,可有效控制城市空气各种污染源
D.汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染
(2)写出CO与NO反应的化学方程式_____________________。
(3)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是___________________________________________。
(4)控制城市空气污染源的方法可以有 (填序号)。
A.开发氢能源 B.使用电动车
C.植树造林 D.戴上呼吸面具
( 5)汽车尾气可引起光化学烟雾,主要是 气体。形成酸雨主要是 气体,在尾气转化中,主要还会产生 气体,造成温室效应。
5)汽车尾气可引起光化学烟雾,主要是 气体。形成酸雨主要是 气体,在尾气转化中,主要还会产生 气体,造成温室效应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com