
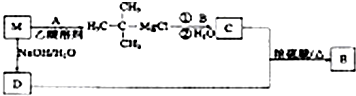
| ||
| ||
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
| A、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| B、2g氢气所含分子数目为2NA |
| C、在标准状况下,以任意比混合的氦气和氧气混合物22.4L,所含分子数为NA |
| D、在25℃、101kPa时,11.2L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2和H2在点燃或光照条件下可合成氨 |
| B、氨是共价化合物,硝酸是离子化合物 |
| C、氨气遇到浓硝酸会发生反应产生白烟 |
| D、由氨制取硝酸过程中,氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
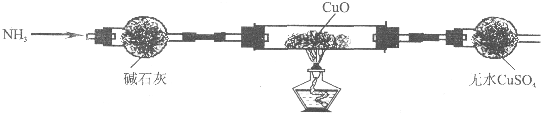
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
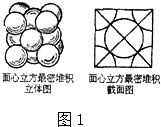 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是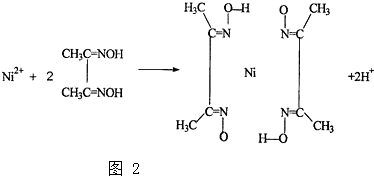
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲、乙中C的体积分数甲>乙 |
| B、平衡时甲中A的转化率为60% |
| C、达到平衡后,再向乙中加入0.8molA+1.2molB+1.2molC,平衡向生成A的正向移动 |
| D、D甲容器达到平衡后,升温,反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
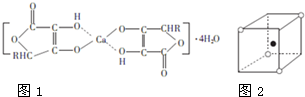 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在干冰晶体中,与一个CO2分子相邻且等距离的CO2分子共有12个 |
| B、在SiO2晶体中,若含有1molSi原子,则Si-O键数为4NA |
| C、在金刚石晶体中,一个碳原子被12个六元碳环所共用,一个C-C键最多可形成6个六元环,一个六元环实际拥有一个碳原子 |
| D、mg石墨中,正六边形数目为m NA/24,每个环拥有碳原子数与C-C键数之比为2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com