
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
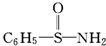 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).分析 (1)(2)题中给出的x值与其原子在分子中吸引电子的能力有关,可根据元素周期性变化来推测Mg和N的x值,以表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化;
(3)对比周期表中对角线位置的X值可知:X(B)>X(Si),X(C)>X(P),X(O)>X(Cl),则可推知:X(N)>X(S);
(4)计算Al、Cl的△x值进行判断;
(5)根据x值的递变规律判断.
解答 解:(1)由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化,故:0.93<x(Mg)<1.57,2.55<x(N)<3.44,
故答案为:0.93;1.57;2.55;3.44;
(2)由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下原子半径增大,而x值减小,故答案为:同周期(或同主族)元素,x值越大,原子半径越小;
(3)对比周期表中对角线位置的X值可知:X(B)>X(Si),X(C)>X(P),X(O)>X(Cl),则可推知:X(N)>X(S),所以S~N中,共用电子对应偏向氮原子,故答案为:氮;
(4)查表知:AlCl3的△X=1.55<1.7,又X(Br)<X(Cl),所以AlBr3的△X应小于AlCl3的,为共价键,故答案为:共价键;
(5)根据递变规律,X值最小的应为Cs(Fr为放射性元素)位于第六周期、第ⅠA族,故答案为:第六周期第ⅠA族.
点评 本题考查电负性的递变规律,题目难度中等,注意元素周期律的主要内容,理解电负性的意义和应用.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
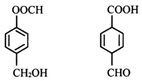
| A. | 均可发生取代、加成反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 分子中共平面的碳原子数相同 | |
| D. | 互为同分异构体,可用NaHCO3溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
| B | 烧杯、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| C | 量筒、玻璃捧、烧杯、100mL容量瓶 | 用浓盐酸配制100mL 0.1mol•L-1的稀盐酸溶液 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用出H2SO4标准液滴定未知浓度的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3溶液与H2SO4溶液混合:S2O32-+4H+═SO42-+S↓+2H2O | |
| B. | 硝酸银溶液中滴入少量氨水:Ag++2NH2•H2O═[Ag(NH3)2]++2H2O | |
| C. | AgI悬浊液中滴入适量Na2S溶液:2AgI+S2-═Ag2S+2I- | |
| D. | Fe(SCN)3溶液中滴入几滴0.01mol/LNaOH溶液:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
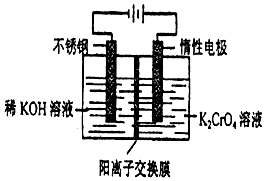 以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )
以10L 0.1mol/L铬酸钾(K2CrO4)溶液为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| B. | 在阴极室,通电后KOH溶液不断变浓,并产生气体H2 | |
| C. | CrO42-通过离子交换膜从阳极区域迁移到阴极区域 | |
| D. | 电解一段时间后测定阳极液中K和Cr的物质的量之比为d,则导线中转移电子的物质的量为(2-d)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原氨水物质的量浓度为0.1mol•L-1 | |
| B. | 反应后的溶液中c(NH+4)+c (NH3•H2O)+c(NH3)=0.1mol•L-1 | |
| C. | 反应后的溶液中:c(Cl-)>c(NH+4)>c(H+)>c( OH-) | |
| D. | 原氨水中:c(NH+4)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Na2CO3溶液用水稀释后,pH变大,Kw不变 | |
| B. | 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变 | |
| C. | pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH) | |
| D. | 分别用pH=2和pH=3的CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va>Vb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “凡造竹纸…用上好石灰化汁涂浆”,造纸利用了石灰的碱性 | |
| B. | “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了置换反应 | |
| C. | 三聚氰胺可用于食品添加剂 | |
| D. | 含Ca(HCO3)2的硬水可通过煮沸的方法使之软化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
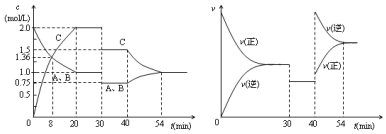
| A. | 前20min B的平均反应速率为0.05mol•L-1•S-1 | |
| B. | 8 min时表示正反应速率等于逆反应速率 | |
| C. | 反应方程式中的x=1,30 min时表示增大压强 | |
| D. | 40 min时改变的条件是升高温度,且正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com