

 .
. 分析 A、B、C、D、E为原子序数依次增大的短周期元素,C元素的最外层电子数比次外层电子数少4,则C元素原子有3个电子层,最外层电子数为4,则C为Si元素;D元素原子序数大于硅元素,处于第三周期,D元素原子次外层电子数比最外层电子数多3,则最外层电子数为8-3=5,则D为磷元素;A、B、E三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝、强酸、强碱之间的反应,则A为Na、B为Al,三种原子最外层共有10个电子,则E的最外层电子数为10-1-3=6,则E为S元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期元素,C元素的最外层电子数比次外层电子数少4,则C元素原子有3个电子层,最外层电子数为4,则C为Si元素;D元素原子序数大于硅元素,处于第三周期,D元素原子次外层电子数比最外层电子数多3,则最外层电子数为8-3=5,则D为磷元素;A、B、E三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝、强酸、强碱之间的反应,则A为Na、B为Al,三种原子最外层共有10个电子,则E的最外层电子数为10-1-3=6,则E为S元素.
(1)由以上分析可知:A为钠,B为铝,C为硅,D为磷,E为硫,
故答案为:钠;铝;硅;磷;硫;
(2)A与E两元素可形成化合物为Na2S,用电子式表示其化合物的形成过程为 ,
,
故答案为: ;
;
(3)A、B两元素的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者相互反应的化学方程式:Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(4)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的离子方程式:2Al+2H2O+2OH-═3H2↑+2AlO2-,
故答案为:2Al+2H2O+2OH-═3H2↑+2AlO2-;
(5)Na2O2的电子式为: ,
,
故答案为: .
.
点评 本题考查结构性质位置关系应用,难度不大,注意基础知识的理解掌握,推断元素是解题的关键.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸滴在纸上使纸变黑,是由于浓硫酸有脱水性 | |
| B. | 稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断用玻璃棒搅拌 | |
| C. | 欲除去CO2中的水蒸气,可将气体通过盛有浓硫酸的洗气瓶 | |
| D. | 不慎在皮肤上沾上少量浓硫酸时,应立即用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以 CH≡CH 和 HCl 反应制氯乙烯,进而制备聚氯乙烯塑料 | |
| B. | 浓氨水滴入生石灰中,将产生的气体通入 AlCl3溶液,可得到含AlO2-的溶液 | |
| C. | 使用催化剂不能改变工业合成 NH3 的反应限度 | |
| D. | 用浸有 KMnO4溶液的硅土来吸收水果释放的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 恒容时,再通入2amolC和2amolD | ||
| C. | 恒压时,再通入2amolC和2amolD | D. | 恒容时,再通入amolA和amolB |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中溶质的质量分数 | B. | 溶液中阳离子数目 | ||
| C. | 溶液的质量 | D. | 浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:4 | B. | 4:5 | C. | 5:12 | D. | 12:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
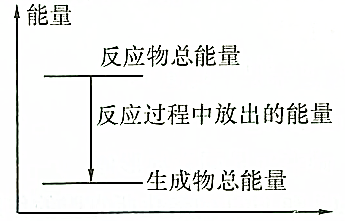
| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1mol锌所含的能量高于1mol H2 所含的能量 | |
| C. | 若将其设计为原电池,则锌为正极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com