
(16分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
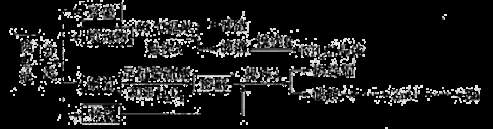
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
(16分) (1)加快溶解速率(1分);(2)过滤(1分)
(3)Cu+H2O2+H2SO4=CuSO4+2H2O(2分); 加热(2分);
(4)Zn+2OH--2e-=Zn(OH)2 (2分)
(5)①4(2分) ②2MnO(OH)+6HCl(浓) 2MnCl2+Cl2↑+4H2O (2分)
2MnCl2+Cl2↑+4H2O (2分)
(6)①先降低后增加(2分) ②氧化性(2分)
【解析】
试题分析:(1)由于物质的溶解速率随温度的升高而增大。所以填充物用60℃温水溶解,目的是加快溶解速率;(2)分离难溶性固体与可溶性液体混合物的操作A的名称为过滤;(3)Cu不能溶于硫酸,在酸性条件下,加入H2O2的Cu就会被溶解变为Cu2+,反应的化学方程式是:Cu+H2O2+H2SO4=CuSO4+2H2O;H2O2不稳定,受热容易分解产生氧气和水,所以铜帽溶解完全后,可采用加热方法除去溶液中过量的H2O2。(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+ 2H2O= 2MnOOH +Zn(OH)2,其负极Zn发生氧化反应,电极反应式为Zn+2OH--2e-=Zn(OH)2 ;(5)①根据方程式2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O可知:当1 mol MnO2参加反应时,共有4mol的电子发生转移;②MnO(OH)与浓盐酸在加热条件下也可发生反应,则该反应的化学方程式是2MnO(OH)+6HCl(浓) 2MnCl2+Cl2↑+4H2O ;(6)①根据在不同pH下,KMnO4溶液对Hg的吸收率的示意图可知:pH对Hg吸收率的影响规律是随pH升高,汞的吸收率先降低后增加;在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下氧化性强的缘故。
2MnCl2+Cl2↑+4H2O ;(6)①根据在不同pH下,KMnO4溶液对Hg的吸收率的示意图可知:pH对Hg吸收率的影响规律是随pH升高,汞的吸收率先降低后增加;在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下氧化性强的缘故。
考点:考查反应条件的选择的原因分析、分离混合物的方法、原电池的电极反应式的书写、氧化还原反应化学方程式和离子方程式的书写、电子转移的计算、物质的吸收率与溶液pH的关系的知识。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
下列说法中,正确的有( )
(1)明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
(2)氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
(3)氨常用作制冷剂,是因为其沸点极低,很容易液化
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
(6)通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
(7)铝粉和氧化镁粉末混合,高温能发生铝热反应
(8)高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
(9)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性
(10)同主族元素的简单阴离子还原性越强,水解程度越大
(11)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(12)在硫酸铜结晶水含量测定实验中,至少要用天平称量三次质量
(13)将水蒸汽通过灼热的铁粉,粉末变红,说明铁在高温条件下可与水发生化学反应
(14)先取少量试液于试管中,再加入氢氧化钠溶液,将润湿的红色石蕊试纸放在试管口,红色石蕊试纸不变蓝,证明溶液中不含铵根离子。
(15)已知次磷酸(H3PO2)是一元中强酸,则NaH2PO2是正盐
A.8句 B.6句 C.5句 D.7句
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:选择题
下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是
A.2Na2O2+CO2→2Na2CO3+O2 B.2Na2O2+2SO3→2Na2SO4+O2
C.Na2O2+H2SO4→Na2SO4+H2O2 D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:填空题
(14分) NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请完成并配平以下化学方程式:
□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+□ 。
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
(5)在微生物作用的条件下, NH4+经过两步反应被氧化成NO3ˉ。两步反应的能量变化示意图如下:

①第一步反应是 反应(填“放热”或“吸热”),
②1mol NH4+(aq)全部氧化成NO3ˉ(aq)的热化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期期中理综化学试卷(A)(解析版) 题型:选择题
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ=Fe(OH)3↓ |
B | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ=Al(OH)3↓ |
C | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl 2溶液 | SO42ˉ+Ba2+=BaSO4↓ |
D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g),则下列说法正确的是
CH3OCH3(g)+H2O(g),则下列说法正确的是
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3 (g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正反应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
已知氧元素有16O、18O两种核素,按中学化学知识要求,下列说法正确的是
A.Na2O2与H218O反应时生成产生18O2气体
B.向2SO2(g) +O2(g)  2SO3(g)的平衡体系中加入18O2,结果18O2只出现在产物中
2SO3(g)的平衡体系中加入18O2,结果18O2只出现在产物中
C.CH3COOH和CH3CH218OH发生酯化反应时,产物中分子式为H218O
D.惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题:
(1)物质C、E分别为 、 。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为 。
(3)反应②的离子方程式为 。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次月考化学试卷(解析版) 题型:推断题
(10分)由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(其它生成物未在图中列出)
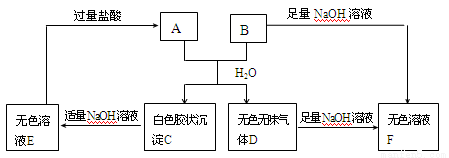
(1)无色溶液F中,一定含有的溶质的化学式为 。
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式________________。
(3)A和B的混合物溶于水发生反应的离子方程式______________________。
(4)将B与E的溶液混合时,可观察到的现象是_________________________,写出其反应的离子方程式__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com