
| A. | 金刚石的稳定性强于石墨 | |
| B. | 12g石墨总键能比12g金刚石小1.9kJ | |
| C. | 石墨和金刚石的转化是物理变化 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol |
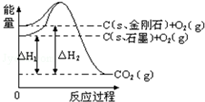
分析 先根据由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、由图象可知,金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故A错误;
B、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,12g石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故B错误;
C、石墨转化为金刚石是发生的化学反应,属于化学变化,故C错误;
D、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故D正确;
故选D.
点评 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.


科目:高中化学 来源: 题型:解答题
 对于密闭容器中的反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)(正反应是放热反应),在673K,30MPa下n(NH3)和n(H2)随时间变化关系如图所示.
对于密闭容器中的反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g)(正反应是放热反应),在673K,30MPa下n(NH3)和n(H2)随时间变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )
X、Y、Z、E、T、G元素在周期表中的相对位置下表,T的最高价氧化物对水化物有强脱水性,Y和Z在同一周期,Y原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | E与G的原子序数相差25 | |
| B. | 常温下,X和Y的单质均能与水剧烈反应 | |
| C. | TE2的熔点高于ZE2晶体 | |
| D. | E、T、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com