
【题目】某电池的简易装置图如下所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )

A. a电极反应式为C2H5OH+12OH――12e-=2CO2↑+9H2O
B. AlCl3溶液中的总反应为2Cl-+2H2O=Cl2↑+H2↑+2OH-
C. 反应开始后,观察到x电极附近出现白色沉淀
D. 左侧电池每通入32gO2,右侧电解池共生成2mol气体
【答案】C
【解析】
分别从A、B处通入乙醇和O2,左侧装置是乙醇燃料电池,a是负极、b是正极;右侧装置为电解池,y是阳极、x是阴极。
A. a是燃料电池负极,a电极反应式为C2H5OH+16OH――12e-=2CO32-+11H2O,故A错误;
B. 电解AlCl3溶液中的总反应为2Al3++6Cl-+6H2O![]() 3Cl2↑+3H2↑+2 Al (OH)3↓,故B错误;
3Cl2↑+3H2↑+2 Al (OH)3↓,故B错误;
C. 反应开始后,x电极的极反应是2Al3++6H2O+6e-= 3H2↑+2 Al (OH)3↓,所以观察到x电极附近出现白色沉淀,故C正确;
D. 左侧电池每通入32gO2,转移4mol电子,右侧电解池生成2mol氢气、2mol氯气,共生成4mol气体,故D错误。


科目:高中化学 来源: 题型:
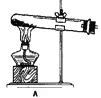
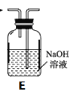
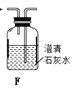
【题目】氮化锂(Li3N)是一种优良的贮氢材料,遇水强烈水解,在空气中加热能剧烈燃烧,下图装置中ABCD用于制取干燥、纯净的N2,装置E用于制取Li3N。
已知:锂的密度为0.534g/cm3,熔点180C,沸点1340C;锂与氨反应生成LiNH2和H2,约500C左右Li与N2反应生成Li3N。

回答下列问题:
(1)连接好装置开始实验前必须进行的操作是___。
(2)实验完成后,A、C、E装置中酒精灯撤去的顺序依次是___,装置F的仪器名称是___。
(3)装置D(未画出)所装药品是___,作用是干燥N2和___。
(4)装置E中石棉绒(透气且性质稳定)包裹的Li的作用是___,后一个Li粒装在铁舟中而不是直接放在反应管中的原因是___。
(5)装置C中反应的化学方程式为___。
(6)已知铁舟中金属锂质量为7.0g,将E中铁舟连同所装固体在实验前后进行称重,所得数据如下表所示,则Li3N的产率约为________%。(保留一位小数)
采集时间 | 实验前 | 实验后 |
实验数据 | 40.2g | 44.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
“玻璃”的品种繁多,比如钢化玻璃、有机玻璃、石英玻璃、变色玻璃等。
①其中石英玻璃的成分是____(填化学式)。
②钢化玻璃和普通玻璃的生产原料相同,它们和制硅酸盐水泥都需用到的共同原料是____(填名称)。
③玻璃中加入适量的溴化银(AgBr)和氧化铜的微小晶粒,经过适当的热处理,可以制成变色玻璃,请写出强光照射变色玻璃时发生反应的化学方程式____。
(2)合理选择饮食,正确使用药物,可以促进身心健康。
①糖类是生命活动的基础能源,油脂、蛋白质也能为人体提供能量。等质量的上述物质中,提供能量最多的是____(选填字母)。
a.糖类 b.油脂 c.蛋白质
②人体牙龈出血、患坏血病主要是缺乏____(选填字母)。
a.维生素A b.维生素B c.维生素C
③合理食用加碘盐是防止缺碘性疾病的有效方法之一。在人体必需元素中,碘属于____(选填“常量”或“微量”)元素。
④复方氢氧化铝可治疗胃酸过多,氢氧化铝与胃酸(HCl)反应的离子方程式为____。
(3)人们的生活与环境密切相关。
①天然水中含有细小悬浮颗粒或胶体颗粒,可以用____(填一种物质的名称)为混凝剂净化处理。
②废旧电池处理不当易造成____污染,治理废水中的该物质可用沉淀法。例如:往含铅(Pb2+)废水中加入Na2S使Pb2+转化为____(填化学式)沉淀而除去。
③某些装修不久的居室中由装潢材料缓慢释放出来的污染物浓度过高,影响人体健康,这种污染物主要是____ (填结构简式)。
④用二氧化碳生产化工产品,有利于二氧化碳的大量回收。CO2和H2在催化剂等条件下可以合成乙醇,该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某0.2L无土栽培用的营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度柱状图如图甲所示:

(1)该营养液中K2SO4的物质的量浓度为____mol·L-1,含KCl的质量为____。
(2)该营养液中NH4Cl的物质的量为____。
(3)将该营养液加水稀释,稀释过程中NH![]() 的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y2(g)![]() 2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是

A. 图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B. 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C. 图Ⅱ中,t时间是增大了压强
D. 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)

④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式___________。
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式___________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母)

A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________。
(6)为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5~10.5,试分析原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性,下列有关说法正确的是
A. H3PO2溶于水的电离方程式为:H3PO2 ![]() 3H++PO23-
3H++PO23-
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4
D. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2--4e-+2H2O=O2+6H++PO23-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度下,在2L的密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) ![]() cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
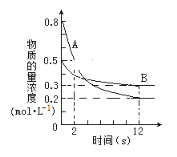
(1)化学计量数b:c=_______
(2)前12s内,A的平均反应速率为________________
(3)12s内,A和B反应放出的热量为__________
Ⅱ.已知:Cu+2FeCl3=2FeCl2+CuCl2利用这一反应,试设计一个原电池,指出电极材料名称,并写出电极反应式
正极:__________ 电极反应:__________________
负极:__________ 电极反应:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为__________(填字母序号)。

![]()

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B中发生反应的离子方程式____________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快” __________(选填“能”或“不能”);简述你的理由:_______________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有(___________)(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
p>①所用指示剂为__________;滴定终点时的现象为_____________________________________;②H2C2O4溶液物质的量浓度为__________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com