
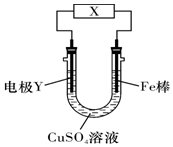
| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
分析 若X为直流电源,装置为电解池,接正极的为阳极,发生氧化反应,接负极的为阴极,发生还原反应;若X为电流计或导线,装置为原电池,活泼金属作负极,发生氧化反应,阴离子向负极移动,阳离子向正极移动,据此解答.
解答 解:A.若X为直流电源,装置为电解池,Y为铜棒接正极,则Fe接负极为电解池的阴极,阴极上铜离子得电子发生还原反应,Fe棒上析出铜,故A正确;
B.若X为直流电源,装置为电解池,Y为碳棒接负极,则Fe接正极为电解池的阳极,发生氧化反应被腐蚀,故B错误;
C.若X为电流计,装置为原电池,Y为锌棒,活泼金属Zn作负极,阴离子SO42- 移向负极Zn,故C错误;
D.若X为导线,装置为原电池,Y为铜棒,活泼金属Fe作负极,Fe棒发生氧化反应,故D错误;
故选A.
点评 本题考查了电解池和原电池的反应原理,注意分清原电池、电解池、电镀池的区别和联系,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| a | ||||
| b | ||||
| c | d | |||
| e |
| A. | b元素除0价外,只有一种化合价 | |
| B. | c元素只能形成一种氢化物且很不稳定 | |
| C. | d元素是五种元素中原子半径最小的一种 | |
| D. | e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
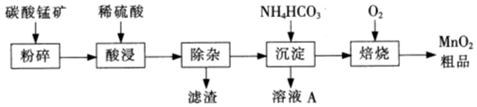
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,5.8g丁烷分子所含的共价键数目为1.4NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下11.2L四氯甲烷所含分子数为0.5NA | |
| D. | 乙烯、丙烯、丁烯的混合气体共28g,其所含的原子总数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同


| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com