
【题目】配平下列氧化还原反应方程式:
(1)______![]() ______HCl—______
______HCl—______![]() ______
______![]() ______
______![]() ______
______![]()
(2)______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______H2O
______H2O
【答案】2 16 2 2 8 5 2 5 6H+ 2 5 8
【解析】
(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数;
(2)反应中MnO4-→Mn2+,Mn元素化合价由+7降低为+2,共降低5价,H2O2→O2,O元素化合价由-1升高为0价,共升高2×1=2价,然后用最小公倍数方法配平参加氧化还原反应的元素,再根据电荷守恒确定缺少的项的微粒及数目,最后配平未参加氧化还原反应的元素。
(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4、MnCl2的系数为2,Cl2的系数为5,HCl的系数是10,再根据K守恒,可知KCl系数是2,由于反应后有6个-1价的Cl,化合价反应前后不变,则反应的HCl的系数应该由10改为10+6=16,根据H守恒,可知H2O的系数为8,所以配平后的方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑,则配平后相应物质的系数由前到后依次为2、16、2、2、8、5;
(2)反应中物质的化合价变化MnO4-→Mn2+,Mn元素化合价由+7价→+2价,共降低5价,H2O2→O2,O元素化合价由-1升高为0价,共升高2×1=2价,元素化合价升降最小公倍数为10,故MnO4-、Mn2+的计量数为2,H2O2、O2的计量数为5,根据电荷守恒,可知缺项微粒为H+,系数是6,然后根据原子守恒配平H2O的系数是8,所以反应方程式为:2MnO4-+5H2O2+6H+=2Mn2++ 5O2↑+8H2O。故方程式由前到后依次为2、5、6H+、2、5、8。


科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同价态氯(或卤素)的归中或歧化反应,试写出下列反应的离子方程式。
(1)次氯酸钠与盐酸反应:________________________。
(2)酸化NaIO3和NaI的混合溶液:_____________________。
(3)氯气通入热的氢氧化钾溶液(生成物中检测出含有氯酸钾):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ·mol-1
N2(g)+2O2(g)2NO2(g) △H2=+68kJ·mol-1
N2(g)+O2(g)2NO(g) △H3=+183kJ·mol-1
脱硝反应△H=___,有利于提高NO平衡转化率的条件是___(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如图所示。
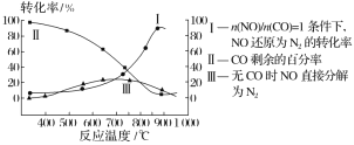
若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可用K2S沉淀Cu2+、Mn2+、Zn2+三种离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )

A.三种离子对应的硫化物的溶度积常数中,Ksp(MnS)最大,约为1×10-15;Ksp(CuS)最小,约为1×10-35
B.MnS+Cu2+![]() CuS+Mn2+,K=1020
CuS+Mn2+,K=1020
C.向ZnS的悬浊液(含ZnS固体)中滴加少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)不变
D.向Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Cu2+最先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:

(1)常温下含碳量最高的气态烃是___(填对应字母);
(2)A分子的空间构型是___;
(3)G的一氯代物有___种;E的二氯代物有___种;
(4)写出C与溴的四氯化碳溶液反应的化学方程式__,反应类型为___。
(5)写出F与浓硝酸和浓硫酸反应的化学方程式___,反应类型为___。
现有上面A、B、C三种有机化合物:(以下均用结构简式作答)
(6)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是___。
(7)等质量的以上三种物质燃烧时,生成二氧化碳最多的是___,生成水最多的是___。
(8)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:

回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是___。
(2)E、G、M三种元素的第一电离能由大到小的顺序为___(用元素符号表示),其原因为___。
(3)G的最简单氢化物的分子立体构型名称为___,M的最简单氢化物的分子中中心原子的杂化类型为___。M和Q的最简单氢化物的沸点大小顺序为___(写化学式)。
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm3。如果TQ的摩尔质量为Mg·mol1,阿伏加德罗常数为NAmol1,则a、b之间的距离为___cm。
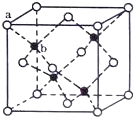
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com