
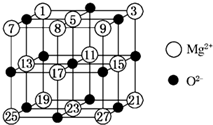
 镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |


科目:高中化学 来源: 题型:
| A、铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
| B、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| C、一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H>0 |
| D、SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④⑤ | B、②③④ |
| C、②⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与盐酸反应:Fe+2H+=Fe3++H2↑ |
| B、氢氧化钡溶液和稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| C、氯化铝中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、向水玻璃中加盐酸:SiO32-+2H+=H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
| B、稀豆浆、云雾、淀粉溶液均为胶体 |
| C、直径介于1 nm~100 nm之间的微粒称为胶体 |
| D、布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:
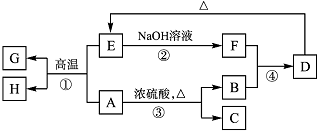 已知A、B、C、D、E、F、G、H可以发生如下图所示的转化(反应过程中部分产物已略去).其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.
已知A、B、C、D、E、F、G、H可以发生如下图所示的转化(反应过程中部分产物已略去).其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物.查看答案和解析>>
科目:高中化学 来源: 题型:
 在密闭容器中,对于可逆反应A+3B?2C(g),平衡时物质C的体积分数与温度、压强的关系如图所示,下列判断正确的是( )
在密闭容器中,对于可逆反应A+3B?2C(g),平衡时物质C的体积分数与温度、压强的关系如图所示,下列判断正确的是( )| A、A一定为气体,B一定为固体或液体 |
| B、B一定为气体,A一定为固体或液体 |
| C、若正反应的△H<0,则T1<T2 |
| D、若正反应的△H<0,则T1>T2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com