
利用海水资源进行化工生产的部分工艺流程如图: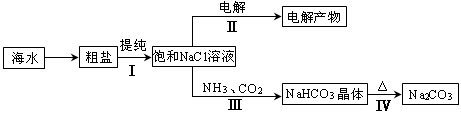
(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。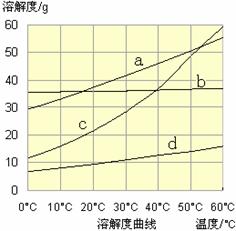
(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2=" +473.63" kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
(16分)
(1)bd(3分,只选b或d得1分,全对得3分,凡其它有错答案不得分)。
(2) 2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)
2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)
(3)d (2分) NaCl + CO2 + NH3 + H2O="=" NaHCO3↓+ NH4Cl(2分,未写“↓”扣1分)
(4)蒸发浓缩 冷却结晶(2分) — 44.00 kJ/mol(3分,无单位扣1分,没有符号“-”的不得分)
解析试题分析:(1)a项,虽然能除去杂质及过量碳酸钠和氢氧化钠,但是过量氯化钡没有除去,故a选项错误;b项,既能除去杂质及过量的氢氧化钠、氯化钡、碳酸钠,又不引入新的杂质,故b选项正确;c项,虽然能除去杂质及过量的氢氧化钠、碳酸钠,但是过量的氯化钡没有除去,故c选项错误;d项,既能除去杂质及过量的氯化钡、碳酸钠、氢氧化钠,又不引入新的杂质,故d选项正确;(2)用惰性电解饱和食盐水可以制备氢氧化钠、氢气、氯气,该反应实质为2Cl-+2H2O 2OH-+H2↑+Cl2↑;阴离子移向阳极,氯离子比氢氧根离子容易失去电子,发生氧化反应,产生黄绿色的气体,即氯气;阳离子移向阴极,氢离子比钠离子容易得到电子,发生还原反应,则阴极产生无色气体,即氢气,由于氢离子被消耗,则阴极附近氢离子浓度减小,所以阴极附近溶液的pH增大;(3)流程III的反应属于复分解反应,即NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl(或者NH3+H2O==NH3?H2O、NH3?H2O+CO2==NH4HCO3、NH4HCO3+NaCl="=" NaHCO3↓+NH4Cl),该反应能够发生的原因是NH4HCO3、NaCl的溶解度均大于NaHCO3,则图中溶解度最小的d表示NaHCO3;(4)由于被提纯物和杂质都是可溶物,杂质可能是NaCl等,根据混合物分离提纯的方法推断,应选择结晶法分离出碳酸钠晶体,因此需要将碳酸钠样品加适量水溶解、蒸发浓缩、冷却结晶或降温结晶、过滤、洗涤,得到纯净的Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠;先将已知两个热化学方程式编号为①②,观察发现①+②可得③Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(g) ΔH3=" +532.36" kJ·mol-1,依题意可知④Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(l) ΔH4=" +92.36" kJ·mol-1,观察发现(④—③)/10可以得到:H2O(g)="=" H2O(l) ΔH=(ΔH4—ΔH3)/10=" —44" kJ·mol-1。
2OH-+H2↑+Cl2↑;阴离子移向阳极,氯离子比氢氧根离子容易失去电子,发生氧化反应,产生黄绿色的气体,即氯气;阳离子移向阴极,氢离子比钠离子容易得到电子,发生还原反应,则阴极产生无色气体,即氢气,由于氢离子被消耗,则阴极附近氢离子浓度减小,所以阴极附近溶液的pH增大;(3)流程III的反应属于复分解反应,即NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl(或者NH3+H2O==NH3?H2O、NH3?H2O+CO2==NH4HCO3、NH4HCO3+NaCl="=" NaHCO3↓+NH4Cl),该反应能够发生的原因是NH4HCO3、NaCl的溶解度均大于NaHCO3,则图中溶解度最小的d表示NaHCO3;(4)由于被提纯物和杂质都是可溶物,杂质可能是NaCl等,根据混合物分离提纯的方法推断,应选择结晶法分离出碳酸钠晶体,因此需要将碳酸钠样品加适量水溶解、蒸发浓缩、冷却结晶或降温结晶、过滤、洗涤,得到纯净的Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠;先将已知两个热化学方程式编号为①②,观察发现①+②可得③Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(g) ΔH3=" +532.36" kJ·mol-1,依题意可知④Na2CO3·10H2O(s)==Na2CO3 (s)+10H2O(l) ΔH4=" +92.36" kJ·mol-1,观察发现(④—③)/10可以得到:H2O(g)="=" H2O(l) ΔH=(ΔH4—ΔH3)/10=" —44" kJ·mol-1。
考点:考查物质制备化学工艺流程,涉及粗盐的分离和提纯、电解饱和食盐水的原理、电极产物及电极附近溶液pH的变化、溶解度曲线在水溶液里复分解反应中的应用、化学方程式、盖斯定律、热化学方程式的书写等。


科目:高中化学 来源: 题型:填空题
工业上合成氨的热反应方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
(1)若已知破坏1mol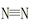 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
(2)在恒温恒压的条件下,将2mol N2和6molH2通入一容积可变的容器中反应,达到平衡后气体的体积为反应前的75%,则该过程释放的能量为 kJ,氮气的转化率为 ,平衡后氨气占混合气体的体积分数为 。
(3)若将1mol N2和1molH2通入两个相同体积的密闭容器甲和乙中,甲容器保持温度和体积不变,乙容器保持温度和压强不变,经过一段时间后,两容器均达到平衡状态。
①建立平衡所需的时间:甲 乙(填“>”,“<”或“=”)
②达到平衡后氨气的体积分数:甲 乙(填“>”,“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe | H2O(g) | Fe3O4 | H2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| | Fe | H2O(g) | Fe3O4 | H2 |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| | Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN-可用H2O2处理。已知:H2SO4=H++ HSO4- HSO4-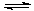 H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含NH4+的废水会发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。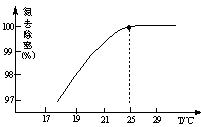
②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究硫及其化合物对于工农业生产具有重要意义。
(1)图Ⅰ所示一个容积为4L的密闭容器,内有可移动的隔板。一定温度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化剂存在下分别发生反应:
左室:
右室:
反应达到平衡时,右室反应过程和能量关系如图Ⅱ所示。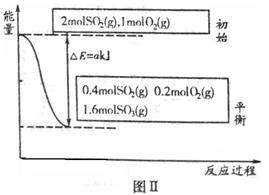
①ΔH2=_______(含a的数学式表示);反应的平衡常数K=_________L·mol-1。
②能说明两边反应一定达到平衡的是______________(填序号)。
A.隔板不再移动
B.左右两边SO2的物质的量相等
C.左右二室中SO2与O2物质的量之比都是2∶1
③达平衡时,左室反应吸收的热量为Q1kJ,右室反应吸收的热量为Q2kJ,则Q1、Q2满足的关系是_____________(填序号)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高温下,炽热的Cu2S与水蒸气反应生成金属铜、H2和SO2(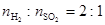 )。
)。
①写出该反应的化学反应方程式_____________________________________________。
②若有1 mol Cu2S参与反应,则转移电子的物质的量是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2.SO2.CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 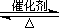 2SO3(g) ?H=-196.6 kJ·mol-1
2SO3(g) ?H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H=-113.0 kJ·mol-1
2NO2(g) ?H=-113.0 kJ·mol-1
(ⅰ)则反应NO2(g)+SO2 (g) SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。
(ⅱ)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.每消耗1 mol SO3的同时生成1 mol NO2 B.体系压强保持不变
C.混合气体颜色保持不变 D. SO3和NO的体积比保持不变
(ⅲ)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图(左)所示。
平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”.“<”或“=”)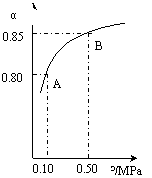
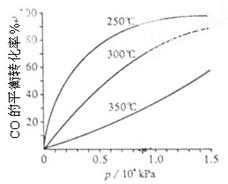
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l) △H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为 。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。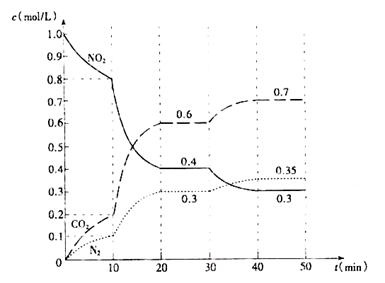
①0?10min内,以CO2表示的平均反应速率v(CO2)= 。
②0~10min,10?20 min,30?40 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为 ,其值是 。
③计算反应达到第一次平衡时的平衡常数K= 。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为 (填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、40?50 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)已知用NaAlO2制备α—Al(OH)3及能量转化关系如图: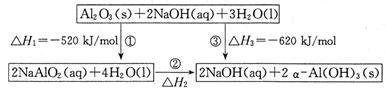
(1)反应②的热化学方程式为 。
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下: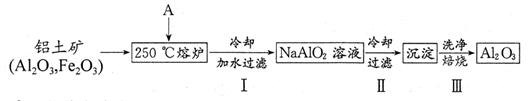
①物质A的化学式为 ;
②步骤Ⅲ的化学反应方程式为 ;检验步骤Ⅲ中沉淀是否洗净的方法是 ;
③步骤Ⅱ采用冷却的方法析出α—Al(OH)3,该措施的依据是 ;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kgAl,则理论上消耗A的物质的量至少为 mol。有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下: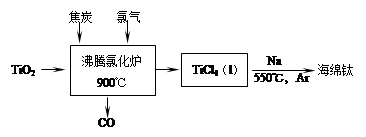
① 沸腾氯化炉中发生的主要反应为: 。
②已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
③ TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电 极,该极电极反应为: 。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种还原性气体,该气体是 。
(3)海绵钛可用碘提纯,原理为: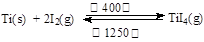 ,下列说法正确的是 。
,下列说法正确的是 。
| A.该反应正反应的ΔH>0 |
| B.在不同温度区域,TiI4的量保持不变 |
| C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区 |
| D.在提纯过程中,I2 可循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com