
������ʵ��������������ԭ�����͵���
���Ȼ�����Һ�����������յò����Ȼ������� �����ڳ�ʪ�Ŀ������������⡡
��ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ�������
�ܳ����£���1 mL pH��3�Ĵ����ˮϡ����100 mL�������pH<5��
�������Ȼ��ع����Ʊ��أ�Na(l)��KCl(l)  K(g)��NaCl(l)��
K(g)��NaCl(l)��
����������������������ƽ����ϵ����ѹ����ɫ����
| A���ڢ� | B���٢ڢ� | C���ڢݢ� | D���٢ۢܢ� |
A
�����������������ΪFeCl3����Һ��ˮ�⣺FeCl3+3H2O Fe(OH)3+3HCl������HCl�ӷ���ƽ�����ƣ����Ȼ�����Һ�����������յò����Ȼ������壻�����ڳ�ʪ�Ŀ������������⣬���ڵ绯ѧ��ʴ������ΪCl2+H2O
Fe(OH)3+3HCl������HCl�ӷ���ƽ�����ƣ����Ȼ�����Һ�����������յò����Ȼ������壻�����ڳ�ʪ�Ŀ������������⣬���ڵ绯ѧ��ʴ������ΪCl2+H2O HClO+H++Cl-������ʳ��ˮ��Cl-�������˷�Ӧ��������У���ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ���������ϡ�ʹٽ��˴���ĵ��룬�����£���1 mL pH��3�Ĵ����ˮϡ����100 mL���ʲ����pH<5���������Ȼ��ع����Ʊ��أ�Na(l)��KCl(l)
HClO+H++Cl-������ʳ��ˮ��Cl-�������˷�Ӧ��������У���ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ���������ϡ�ʹٽ��˴���ĵ��룬�����£���1 mL pH��3�Ĵ����ˮϡ����100 mL���ʲ����pH<5���������Ȼ��ع����Ʊ��أ�Na(l)��KCl(l)  K(g)��NaCl(l)��K�����ݳ���ʹƽ�������ƶ�������������������������ƽ����ϵ����ѹ����ɫ�������Ϊ��ѹ��С�����������NO2��Ũ�ȣ���ɫ�����ƽ���ƶ��ء�
K(g)��NaCl(l)��K�����ݳ���ʹƽ�������ƶ�������������������������ƽ����ϵ����ѹ����ɫ�������Ϊ��ѹ��С�����������NO2��Ũ�ȣ���ɫ�����ƽ���ƶ��ء�
���㣺�ж���������ԭ�����͵ķ�Ӧԭ����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����¶ȣ��������ݲ�һ���������
A����ѧ��Ӧ����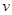 | B��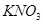 ���ܽ��S ���ܽ��S |
| C����ѧƽ�ⳣ��K | D��ˮ�����ӻ�����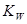 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ѧ��һֱ�����ڡ��˹��̵������·����о���Ŀǰ�ϳɰ�����ԭ��Ϊ��
N2(g) + 3H2(g) 2NH3(g)����H=��92.4kJ��mol��1����673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ� ��
2NH3(g)����H=��92.4kJ��mol��1����673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ� ��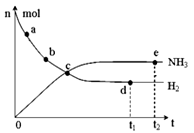
| A����a������Ӧ���ʱȵ�b�Ĵ� |
| B����c����Ӧ�ﵽ��ѧƽ��״̬ |
| C����d�͵�e����n(N2)����ͬ |
| D����e��Ӧ�ﵽ��ѧƽ��״̬����Ӧֹͣ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��t��ʱ��10mL0.4mol��L��1H2O2��Һ�������ֽ⣺2H2O2 = 2H2O + O2������ͬʱ�̲������O2�������������Ϊ��״�������±�
| t /min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��£����淴ӦA(��)��3B(��) 2C(��)�ﵽƽ��ı�־��
2C(��)�ﵽƽ��ı�־��
A��C���ɵ�������C�ֽ���������
B��A��B��C��Ũ�����
C��A��B��C�ķ�������Ϊ1:3:2
D����λʱ������n mol A��ͬʱ����3n mol B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��10�֣�800��ʱ��2L�ܱ������ڷ�Ӧ��2NO��g��+O2��g�� 2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0��020 | 0��010 | 0��008 | 0��007 | 0��007 | 0��007 |
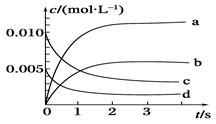
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Ӧ4NH3+5O2=4NO+6H2O��5 L���ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol����˷�Ӧ��ƽ�����ʱ�����ȷ����
| A��v(O2)=0.01mol��L-1��s-1 | B��v(NO)="0.008" mol��L-1��s-1 |
| C��v(H2O)="0.003" mol��L-1��s-1 | D��v(NH3)="0.004" mol��L-1��s-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴Ӧ��2NO2(g) 2NO(g)��O2(g)��������̶����ܱ������У��ﵽƽ��״̬�ı�־��
2NO(g)��O2(g)��������̶����ܱ������У��ﵽƽ��״̬�ı�־��
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
�ڵ�λʱ��������n mol O2��ͬʱ����2n mol NO������NO2��NO��O2��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬���ܻ���������ɫ���ٸı��״̬ ���ݻ��������ܶȲ��ٸı��״̬ �� ��������ѹǿ���ٸı��״̬�� ��������ƽ����Է����������ٸı��״̬
| A���٢ܢޢ� | B���ڢۢݢ� |
| C���٢ۢܢ� | D��ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ʵ��������������ԭ�����͵��� �� ��
| A����ҵ��������Ĺ�����ʹ�ù���������������߶��������ת���ʡ� |
| B���ϳɰ�����ͨ������20MPa��50MPaѹǿ�������ԭ�ϵ������ʣ� |
| C����������ֽ�Ӷ���������������ʹ��λʱ���ڲ��������������ࡣ |
| D�����Ƶ���ˮPHֵ��С�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com