
分析 (1)S的原子结构中有3个电子层,最外层电子数为6;连二亚硫酸是一种二元弱酸,存在电离平衡;
(2)Na2S208+Cu═Na2SO4+CuSO4中,S元素的化合价降低,Cu元素的化合价升高;
反应开始一段时间后反应速率明显加快与催化剂有关;
(3)反应生成Na2S2O4,还生成二氧化碳和水;
(4)电解NaHSO4水溶液可得到Na2S2O8,S元素的化合价升高,应在阳极上失去电子生成Na2S2O8,则阴极氢离子放电,溶液中阳离子向阴极移动.
解答 解:(1)S的原子结构中有3个电子层,最外层电子数为6,则硫位于元素周期表中第三周期ⅥA族,连二亚硫酸是一种二元弱酸,连二亚硫酸的第一步电离方程式为H2S204?HS204-+H+,故答案为:三;ⅥA;H2S204?HS204-+H+;
(2)Na2S208+Cu═Na2SO4+CuSO4中,S元素的化合价降低,得到电子被还原,则还原产物为Na2SO4、CuSO4;反应开始较慢,反应开始一段时间后反应速率明显加快,原因可能为Cu2+是反应的催化剂,故答案为:Na2SO4、CuSO4;Cu2+是反应的催化剂;
(3)反应生成Na2S2O4,还生成二氧化碳和水,则该反应为NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O,故答案为:NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O;
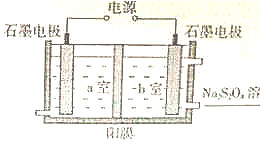
(4)电解NaHSO4水溶液可得到Na2S2O8,S元素的化合价升高,应在阳极上失去电子生成Na2S2O8,由图可知,左侧为阴极,右侧为阳极,
①阴极氢离子放电,生成氢气,即阴极产物为H2,故答案为:H2;
②电解NaHSO4水溶液可得到Na2S2O8,发生2NaHSO4$\frac{\underline{\;电解\;}}{\;}$Na2S2O8+H2↑,阳极反应为2SO42--4e-=S2O82-,故答案为:2SO42--4e-=S2O82-;
③溶液中阳离子向阴极移动,图中为阳离子交换膜,则能穿过离子交换膜的离子是Na+,离子的移动方向为b→a,故答案为:Na+;b→a.
点评 本题考查较综合,涉及电离、氧化还原反应、电化学及反应速率的影响因素等,侧重化学反应原理中高频考点的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| B. | 2 mol水的总能量高于2 mol氢气和1 mol氧气的总能量 | |
| C. | 断裂2 molH-H键和断裂1 molO═O键吸收的总能量低于形成4 molH-O键放出的总能量 | |
| D. | 断裂4 molH-O键吸收的总能量高于形成2 molH-H键和形成1 molO═O键放出的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
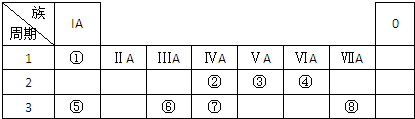
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com