
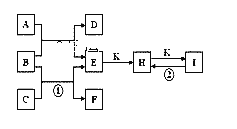
【题目】如图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
请回答下列问题:
(1)物质A的化学式为________;物质D的名称________;
(2)化合物I的化学式为_____________________;
(3)反应①的化学方程式为_______________________________________;
反应②的化学方程式为_______________________________________;
A与B反应的化学方程式________________________________________;
【答案】Na2O2 氧气 NaHCO3 2Na+2H2O=2NaOH+H2↑ 2NaHCO3![]() Na2CO3+H2O+CO2↑或NaHCO3+ NaOH= Na2CO3+H2O 2Na2O2+2H2O=4NaOH+O2↑
Na2CO3+H2O+CO2↑或NaHCO3+ NaOH= Na2CO3+H2O 2Na2O2+2H2O=4NaOH+O2↑
【解析】
A是由单质C在D中燃烧生成的淡黄色固体,可判断A为过氧化钠,C为Na,D为氧气;B是最常见的无色液体,可与过氧化钠反应生成氢氧化钠和氧气,则B为水;K为无色无刺激性气体,且能与氢氧化钠反应,则K为二氧化碳;H为碳酸钠,碳酸钠与二氧化碳、水反应生成碳酸氢钠,则I为碳酸氢钠。
(1)分析可知,物质A为过氧化钠,其化学式为Na2O2;物质D为氧气;
(2)化合物I为碳酸氢钠,化学式为NaHCO3;
(3)反应①为Na与水反应生成氢氧化钠和氢气,方程式为2Na+2H2O=2NaOH+H2↑;
反应②为碳酸氢钠受热分解生成二氧化碳、水和碳酸钠,或碳酸氢钠与氢氧化钠反应生成碳酸钠和水,方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑、NaHCO3+ NaOH= Na2CO3+H2O;
Na2CO3+H2O+CO2↑、NaHCO3+ NaOH= Na2CO3+H2O;
A与B分别为过氧化钠、水,其反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑;


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】酶在生命活动和工业生产中都有很好的催化效果。有下列物质的转化关系:
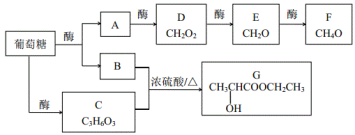
(1)E→F的反应类型____;有机物B、C都含有的官能团名称____。
(2)下列说法正确的是___。
A.可以用![]() 溶液鉴别物质B、C、D
溶液鉴别物质B、C、D
B.物质C和D均可以发生取代反应
C.质量相同的葡萄糖和E完全燃烧,葡萄糖耗氧量多
D.物质F一定条件可以转化为E,E也可以转化为D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:
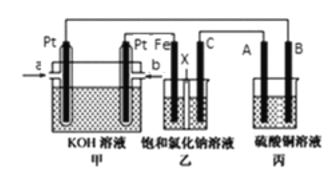
(1)从a口通入的气体为_______。
(2)B电极的电极材料是______。丙池中铜离子浓度______(填“变大”“变小”或不变)。
(3)写出甲中通甲烷一极的电极反应式:________________________________。
(4)写出乙中发生的总反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是 ( )
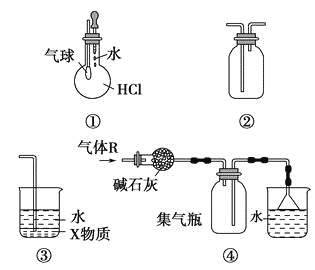
A.装置①可验证HCl气体在水中的溶解性
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2、NO等
C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:
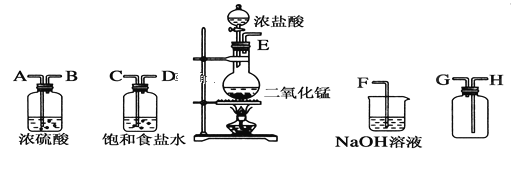
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。
(3)①气体发生装置中进行反应的化学方程式:_____________________________;该方程式中体现浓盐酸的__________________、____________________ 性质;氧化剂和还原剂的物质的量之比:________________________________________;
②NaOH溶液中发生反应的离子方程式:_______________________________________;
(4)实验室用下列方法制取氯气:①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,则反应后所得氯气的物质的量(_____)
A.①比②多 B.②比①多 C.两种方法一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.恒温恒容密闭容器中反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡
2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡
B.汽车尾气催化净化时的反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2
N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2
C.某恒容密闭容器中反应:nA(g)+mB(g)![]() pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大
pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大
D.2NO2(g) ![]() N2O4(g)在常温下即可进行,说明正反应是放热反应
N2O4(g)在常温下即可进行,说明正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是( )。
。下列说法正确的是( )。
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为共价化合物
C.M2Z2有强氧化性,分子中只有共价键
D.由X、Y、Z、M四种元素形成的化合物可能既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),于2019年5月2日正式生效。设NA是阿伏加德罗常数的值,下列说法正确的是
A.40g正丁烷和18 g异丁烷的混合物中共价键数目为13NA
B.常温常压下,124 g P4中所含P—P键数目为4NA
C.电解精炼铜时,阳极质量减小3.2g时,转移的电子数为0.1NA
D.0.1mol FeCl3完全水解转化为氢氧化铁胶体,生成胶粒数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下可利用甲烷消除氮氧化物的污染,例如:CH4+2NO2N2+CO2+2H2O。在2L密闭容器中,控制在不同温度下,分别加入0.50molCH4和0.90molNO2,测得n(CH4)随时间变化的有关实验数据如下表所示。
组别 | 温度 | n/mol | 时间/min | ||||
0 | 10 | 20 | 40 | 50 | |||
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法不正确的是
A.组别①中,0~20min内,NO2的降解速率为0.025mol·L-1·min-1
B.该反应的△H<0
C.40min时,x的数值应为0.15
D.0~20min内NO2的降解百分数①<②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com