
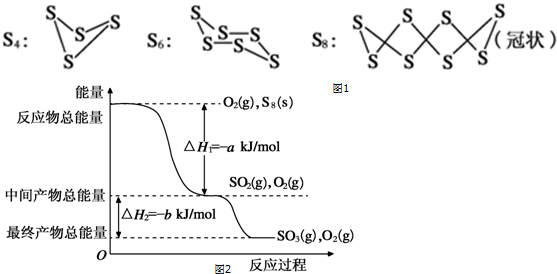
分析 (1)A.同种元素形成的不同单质是同素异形体;
B.同素异形体间的转化是化学变化;
C.硫元素组成的单质燃烧产物是二氧化硫;
D.单质硫为分子晶体;
E.一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个;
(2)当S2、S4 时S2分子的体积分数最小;结合平均值方法计算体积分数;
(3)①S8(s)和O2(g)发生反应转化为SO2(g)时放热为燃烧热,标注物质聚集状态和反应焓变写出热化学方程式;
②分析图象能量变化,写出化学方程式,标注物质聚集状态和反应焓变写出热化学方程式.
解答 解:(1)A.同种元素形成的不同单质是同素异形体,故A错;
B.同素异形体间的转化是化学变化,故B错;
C.硫元素组成的单质燃烧产物是二氧化硫,故C正确;
D.常温下单质硫为分子晶体,故D错误;
E.一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个,32gS8单质物质的量=$\frac{32g}{8×32g•mo{l}^{-1}}$=0.125mol,含有的S-S键个数为NA,故E正确;
故答案为:CE;
(2)当S2、S4时S2分子的体积分数最小,设S2物质的量为X,S4物质的量为Y,$\frac{64X+128Y}{X+Y}$=80;得到X:Y=3:1,相同条件下气体物质的量之比等于体积之比物得到,该蒸气中S2分子的体积分数不小于75%,
故答案为:75%;
(3)①S8(s)和O2(g)发生反应转化为SO2(g)时放热为燃烧热,由图可知生成1molSO2(g)放出热量为akJ,
则燃烧热的S8(s)+8O2(g)═8SO2(g)△H=-8akJ•mol-1,
故答案为:S8(s)+8O2(g)═8SO2(g)△H=-8akJ•mol-1;
②依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,
SO3分解生成SO2和O2的热化学方程式为:SO3(g)=SO2(g)+$\frac{1}{2}$O2(g)△H=+bKJ/mol,
故答案为:SO3(g)=SO2(g)+$\frac{1}{2}$O2(g)△H=+bKJ/mol.
点评 本题考查了反应能量变化的分析判断,焓变的计算应用,热化学方程式的书写,图象分析和概念理解是解题关键,题目难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2-、Cl-、K+ | B. | Cl-、Na+、Al3+ | C. | Na+、Mg2+、F- | D. | O2-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾和镁的次外层电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 等体积的CO和NO含有的原子数 | |
| D. | 等物质的量的钠分别在常温下和点燃条件下与氧气反应转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制铝:以铝土矿为原料获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 | |
| B. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融氧化镁得镁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 制铁:以铁矿石为原料,利用焦炭与氧气反应生成的CO在高温下还原得铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
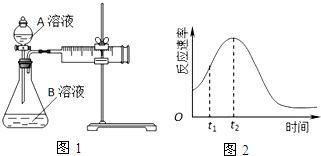
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com