
【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
【答案】> > ![]() CH3COOH>H2CO3>HClO > 4 c(A-)>c(Na+)>c(H+)>c(OH-)
CH3COOH>H2CO3>HClO > 4 c(A-)>c(Na+)>c(H+)>c(OH-) ![]()
【解析】
(1)①ClO-水解,根据电荷守恒及NaClO溶液碱性强,因此NaClO溶液c(OH-)大,c(H+)小得出结论;
②根据NaHCO3溶液的pH计算HCO3-的水解常数,在相同温度下,根据同浓度对应盐的碱性大小得出酸性强弱为CH3COOH>H2CO3>HClO,酸性越强,同浓度电离出的离子浓度越大,导电性越强。
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,如果pH =a的HCl中加入等体积NaOH时后呈中性,则NaOH的pH = 14a,但醋酸是弱酸,物质的量比盐酸多,则消耗的氢氧化钠也多。
(3)①常温下,0.1molL1一元酸HA溶液中![]() =1×106,结合水的离子积计算c(H+) ;
=1×106,结合水的离子积计算c(H+) ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,混合后溶液显酸性,溶质为NaA和HA,HA的电离程度大于NaA的水解程度,溶液显酸性。
⑷根据混合后溶液显中性,溶质为硫酸铵和氨水的混合物及电荷守恒、物料守恒计算NH3·H2O的电离平衡常数。
⑴①ClO-水解,因此等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl和ClO离子个数:Cl- > ClO-;根据电荷守恒c(Na+)+ c(H+) = c(ClO-) + c(OH-),c(Na+) c(ClO-) = c(OH-) c(H+),c(K+) +c(H+)= c(CH3COO-)+c(OH-),c(K+)c(CH3COO-)= c(OH-) c(H+),NaClO碱性强,因此NaClO溶液c(OH-)大,c(H+)小,两者差值大,因此浓度相等的NaClO和CH3COOK溶液中:[c(Na+)c(ClO-)] >[c(K+)c(CH3COO-)];故答案为:>;>。
②0.1mol/LNaHCO3溶液的pH为8.3,即c(H+)=10-8.3,根据HCO3-+H2OH2CO3+OH-,HCO3-的水解常数为![]() ;在相同温度下,0.1mol/LCH3COOK、NaClO、NaHCO3溶液的pH依次为8.1、9.7、8.3,根据“越弱越水解”得出酸性强弱为CH3COOH>H2CO3>HClO,酸性越强,同浓度电离出的离子浓度越大,导电性越强,因此同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为CH3COOH>H2CO3>HClO;故答案为:
;在相同温度下,0.1mol/LCH3COOK、NaClO、NaHCO3溶液的pH依次为8.1、9.7、8.3,根据“越弱越水解”得出酸性强弱为CH3COOH>H2CO3>HClO,酸性越强,同浓度电离出的离子浓度越大,导电性越强,因此同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为CH3COOH>H2CO3>HClO;故答案为:![]() ;CH3COOH>H2CO3>HClO。
;CH3COOH>H2CO3>HClO。
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,如果pH =a的HCl加入等体积NaOH时后呈中性,则NaOH的pH = 14a,但醋酸是弱酸,物质的量比盐酸多,则消耗的氢氧化钠也多,而体积相同,则需要的碱性更强,因此NaOH的pH> 14a;故答案为:>。
(3)①常温下,0.1molL1一元酸HA溶液中![]() =1×106,c(H+)c(OH-)=1×10-14,解得c(H+) =1×104 molL1,则0.1 molL1 HA溶液的pH=4;故答案为:4。
=1×106,c(H+)c(OH-)=1×10-14,解得c(H+) =1×104 molL1,则0.1 molL1 HA溶液的pH=4;故答案为:4。
②pH=3span>的HA与pH=11的NaOH溶液等体积混合后,充分反应后得到溶液的溶质为NaA和HA,HA的电离大于NaA水解,溶液显酸性,因此溶液中4种离子物质的量浓度大小关系是c(A-)>c(Na+)>c(H+)>c(OH-);故答案为:c(A-)>c(Na+)>c(H+)>c(OH-)。
(4)常温下,a molL1氨水与等体积0.1 molL1H2SO4溶液混合后溶液显中性,c(H+)=c(OH-)=1×10-7mol/L,溶质为硫酸铵和氨水的混合物,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则c(NH4+)=0.1mol/L,根据物料守恒c(NH4+)+c(NH3·H2O)=![]() mol/L,c(NH3·H2O)=(
mol/L,c(NH3·H2O)=(![]() -0.1)mol/L,则NH3·H2O的电离平衡常数
-0.1)mol/L,则NH3·H2O的电离平衡常数 ;故答案为:
;故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在甲、乙、丙、丁四个烧杯中分别放入![]() 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )
的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )
A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.用水稀释0.1mol·L-1的氨水,则溶液中![]() 减小
减小
B.pH=3的盐酸和醋酸分别升高相同的温度,CH3COOH的pH变大
C.在等体积等浓度的盐酸和醋酸中分别加入等质量的相同锌粒,随着反应的进行,醋酸不断电离出H+,反应速率比盐酸大
D.两种氨水的pH分别为a和a+1,物质的量浓度分别为c1和c2,则c2<10c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2SO3的电离常数:Ka1=1.54×102,Ka2=1×107。向mmL0.1mol/LH2SO3溶液中滴加0.1mol·L1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法不正确的是

A.m=10
B.c点对应的溶液中存在c(K+)>c(HSO3-)+2c(SO32)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH的K=1×107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过一硫酸氢钾复合盐(KHSO4·2KHSO5·K2SO4)常用作漂白剂和消毒剂,其制备流程如下:
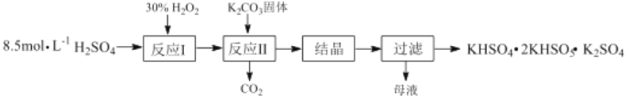
(1)反应Ⅰ的化学方程式为:H2O2+H2SO4![]() H2SO5+ H2O,△H<0;则反应Ⅱ中K2CO3与H2SO5反应生成KHSO5的化学方程式为_____________。
H2SO5+ H2O,△H<0;则反应Ⅱ中K2CO3与H2SO5反应生成KHSO5的化学方程式为_____________。
(2)生产原料的理论比值[n(H2O2):n(H2SO4)]为0.4:1,但实际生产最佳投料比为 0.6:1,其原因是_________________。
(3)过一硫酸氢钾复合盐可以处理废水中的H2S。己知:25℃,H2S的电离常数Ka1=1.1×10-7, Ka2=1.3×10-13由于电离常数值极小,H2S水溶液中H2S的平衡浓度近似等于H2S的初始浓度。0.090 mol·L-1H2S溶液的pH=4,该溶液中c(S2-)=________________。
(4)准确称取3.350g复合盐样品配制成250mL溶液,取25.00 mL置于锥形瓶中,加入适量的稀硫酸和足量的KI溶液,摇匀后置于暗处,充分反应后,加入少量淀粉溶液,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消粍标准溶液20.00 mL。计算复合盐中有效成分KHSO5的质量分数。(写出计算过程)(已知:HSO5- ![]() I2
I2 ![]() S4O62-)________________________。
S4O62-)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
C.反应:CO+NO2![]() CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
D.对2H2O2![]() 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
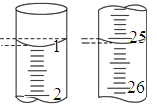
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(4)某学生根据3次实验分别记录有关数据如表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
依据上表数据列式计算该NaOH溶液的物质的量浓度为_____________ mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述错误的是( )

A.该有机物的分子式可能为![]()
B.该有机物分子中的所有原子在同一平面上
C.该有机物无相同官能团同分异构体
D.该有机物可以和氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为改进金属钠与氯气反应的实验,设计了如下装置。
![]()
可供选择的试剂有:金属钠、MnO2、KClO3固体、盐酸、NaOH溶液、澄清石灰水。
(1)玻璃仪器C的名称是____。
(2)针筒A中放的是盐酸,则B中放的是____。
(3)针筒D的作用是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com