
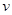 (
(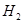 )="3mol" ?L-1 ?s-1
)="3mol" ?L-1 ?s-1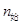 40 120 0
40 120 0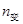 20 60 40
20 60 40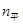 20 60 40
20 60 40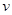 (
(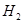 )=
)=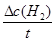 =
=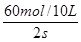 ="3mol" ?L-1 ?s-1
="3mol" ?L-1 ?s-1 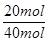 ×100%=50%
×100%=50% 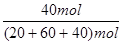 =33.3%
=33.3% 

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
 pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是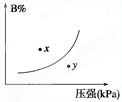
| A.①②⑤ | B.只有②④ | C.只有①③ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。| A.①、③和⑥ | B.②、③和⑥ | C.①、④和⑥ | D.②、③、⑤和⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 ( )
2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 ( )| A.X2为0.4mol·L—1,Y2为1.2mol·L—1 | B.Y2为1.0mol·L—1 |
| C.X2为0.3mol·L—1,Z为0.2mol·L—1 | D.Z为0.6mol·L—1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = (2)从反应开始到40s达平衡状态,A的平均反应速率为 (3)平衡时容器中B的体积分数为 (4)该温度下此反应的平衡常数表达式为 数值是 (5)下列各项能表示该反应达到平衡状态是
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = (2)从反应开始到40s达平衡状态,A的平均反应速率为 (3)平衡时容器中B的体积分数为 (4)该温度下此反应的平衡常数表达式为 数值是 (5)下列各项能表示该反应达到平衡状态是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨水应密闭保存,放置低温处 |
| B.在FeSO4溶液中,加入Fe粉以防止变质 |
| C.生产硝酸的过程中使用过量空气以提高氨气的利用率 |
| D.实验室常用排饱和食盐水的方法收集Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: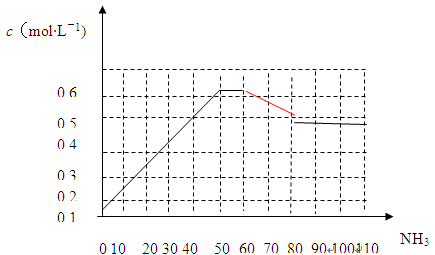
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
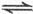 N
N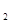 O
O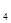 ,下列不能说明反应达到了平衡状态的是
,下列不能说明反应达到了平衡状态的是A.N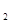 O O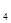 生成速率与N 生成速率与N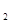 O O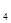 分解速率相等时 分解速率相等时 |
| B.混合气体平均相对分子质量保持不变时 |
C.NO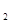 的分子数与N 的分子数与N O O 分子数比为2:1时 分子数比为2:1时 |
| D.体系颜色不再发生改变时 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com