
| A. | 氯化氢比硫化氢稳定 | B. | 次氯酸的氧化性比硫酸强 | ||
| C. | 高氯酸的酸性比硫酸的强 | D. | 氯气能与硫化氢反应生成硫 |
科目:高中化学 来源: 题型:选择题
 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3molClO-参加反应时,则有1molN2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5molClO-参加反应时,则有1molN2生成 | |
| D. | 若生成2.24LN2,则转移电子0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
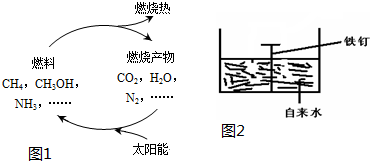
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一组 | He | -268.8 | (a) | -249.5 | Ar | -185.8 | Kr | -151.7 |
| 第二组 | F2 | -187.0 | Cl2 | -33.6 | (b) | 58.7 | I2 | 184.0 |
| 第三组 | (c) | 19.4 | HCl | -84.0 | HBr | -67.0 | HI | -35.3 |
| 第四组 | H2O | 100.0 | H2S | -60.2 | (d) | -42.0 | H2Te | -1.8 |
| A. | abc的化学式分别为Ne2、Br2、HF | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr<d | |
| C. | 第三组物质溶于水后,溶液的酸性c最强 | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
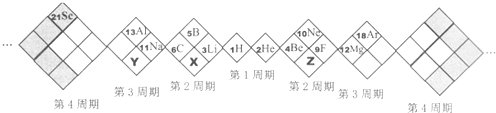
| A. | X、Y、Z元素分别为N、P、O | B. | 所列元素都是主族元素 | ||
| C. | 原子半径:Z>X>Y | D. | 稳定性:X的氢化物<Y的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com